
(1)BaSO4 (s)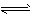 Ba2+ (aq)+SO42- (aq)
Ba2+ (aq)+SO42- (aq)
Ksp=c(Ba2+)·c(SO42-)
C2(Ba2+)=1.1×10-10 ,c(Ba2+) =1. 05×10-5 mol.·L-1<2 ×10-3 mol·L-1,
SO42-是强酸酸根离子,在溶液中它难以与H+ 结合成硫酸,因此胃液中H+对BaSO4的沉淀溶解平衡基本没有影响,Ba2+浓度可以保持在安全浓度标准以下,因此BaSO4可用做“钡餐”。
(2)BaCO3 (s)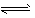 Ba2+ (aq)+CO32- (aq),由于胃液是酸性的,如果服下BaCO3,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,Q<Ksp,从而使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。
Ba2+ (aq)+CO32- (aq),由于胃液是酸性的,如果服下BaCO3,胃酸可与CO32-反应生成二氧化碳和水,使CO32-的浓度降低,Q<Ksp,从而使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大而引起人体中毒。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009年浙江省高考化学模拟试卷(一)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com