Ⅰ.菠菜是常见蔬菜,100g菠菜中含有的营养成分为:草酸0.2-0.3g,水91.2g,蛋白质2.6g,脂肪0.3g,纤维素1.7g,糖类2.8g,维生素B1 0.04mg,维生素B2 0.11mg,维生素C 32mg,维E 1.74mg,Fe 2.9mg,Se 0.97g,胡萝卜素2.92mg,视黄醇0.487mg等.
(1)菠菜中铁的主要存在价态是______.
(2)验证菠菜中草酸的存在要先把草酸从菠菜中分离出来,然后利用钙离子将草酸从溶液中以沉淀(A)的形式分离,过滤后用酸重新溶解、蒸发、结晶(B).沉淀A的化学式是______.
(3)结晶B在热天平差热分析联用的仪器中加热,测得在0-120℃、120-450℃、450-800℃三区间失重率之比为9:14:22,确定B的化学式______,写出三个区间分解反应方程式______.
(4)定量测定结晶中B的含量:取结晶固体0.1280g加入0.2mol/L 盐酸15mL(用量筒量取),使固体全部溶解,然后用0.0200mol/L 的KMnO4溶液滴定,至锥形瓶中紫色不褪,用去KMnO4溶液16.20mL.计算结晶中B百分含量______.
Ⅱ.25℃时,Ksp(CaSO4)=7.10×10-5.在1L0.1mol?L-1CaCl2溶液中加入1L0.2mol?L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为______mol?L-1.
解:Ⅰ.(1)人体需要的铁元素是亚铁离子,三价铁离子有毒,所以菠菜中铁元素价态为+2价,故答案为:+2;
(2)利用钙离子将草酸从溶液中以沉淀(A)的形式分离,草酸和钙离子结合生成草酸钙沉淀,故答案为:CaC
2O
4;
(3)结晶B在热天平差热分析联用的仪器中加热,测得在0-120℃、120-450℃、450-800℃三区间失重率之比为9:14:22,数据扩大2倍,失重比为18:28:44,结合温度变化区间可知分别失去H
2O、CO、CO
2;失重的反应化学方程式为:CaC
2O
4?H
2O═CaC
2O
4+H
2O、CaC
2O
4═CaCO
3+CO、CaCO
3═CaO+CO
2 ,推断B晶体为CaC
2O
4?H
2O,
故答案为:CaC
2O
4?H
2O;CaC
2O
4?H
2O═CaC
2O
4+H
2O、CaC
2O
4═CaCO
3+CO、CaCO
3═CaO+CO
2;
(4)CaC
2O
4+HCl═H
2C
2O
4+CaCl
2;H
2C
2O
4+2MnO
4-+6H
+═2Mn
2++10CO
2↑+8H
2O,已经反应的定量关系B的物质的量等于草酸的物质的量,依据高锰酸钾溶液的用量计算得到:
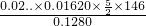
×100%=92.4%,故答案为:92.4%;
Ⅱ.1L0.1mol?L
-1CaCl
2溶液中加入1L0.2mol?L
-1的Na
2SO
4溶液,充分反应后,Na
2SO
4过量,反应后溶液中c(SO
42-)=
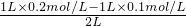
=0.05mol/L,
又:Ksp(CaSO
4)=c(Ca
2+)×c(SO
42-)=7.10×10
-5,
c(Ca
2+)=
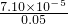
mol/L=1.42×10
-3mol/L,故答案为:1.42×10
-3.
分析:Ⅰ.(1)人体需要的铁元素是亚铁离子,三价铁离子有毒;
(2)草酸和钙离子结合生成草酸钙沉淀;
(3)依据在0-120℃、120-450℃、450-800℃三区间失重率之比为9:14:22的数值特点分析判断;
(4)依据反应过程中的化学方程式和离子方程式的定量关系,结合滴定实验数据计算结晶中B百分含量,CaC
2O
4+HCl═H
2C
2O
4+CaCl
2;H
2C
2O
4+2MnO
4-+6H
+═2Mn
2++10CO
2↑+8H
2O;
Ⅱ.依据溶度积的含义计算得到.
点评:本题考查了物质组成实验探究,滴定实验数据的分析判断计算应用,难溶物质的溶度积计算应用,题目难度中等.

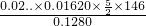 ×100%=92.4%,故答案为:92.4%;
×100%=92.4%,故答案为:92.4%;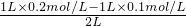 =0.05mol/L,
=0.05mol/L,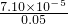 mol/L=1.42×10-3mol/L,故答案为:1.42×10-3.
mol/L=1.42×10-3mol/L,故答案为:1.42×10-3.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案