

解:
(1)利用过氧化钠与水反应生成氧气,然后排水量气法测定氧气的体积,进而计算Na2O2试样的纯度,故选择⑤①④,
故答案为:A;
(2)由(1)分析可知,需要的药品为蒸馏水;
装置的组装顺序:固体混合物与水反应,吸收生成的氧气中的水蒸气,用排水量气法测定氧气的体积,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积,故连接顺序为:(G)接(A)(B)接(F),
故答案为:蒸馏水;(G)接(A)(B)接(F);
(3)Na2O2与是反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,Na2O与水反应的离子方程式为2Na2O+2H2O═4Na++4OH-,
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;2Na2O+2H2O═4Na++4OH-;
(4)
①令碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据钠离子守恒、碳元素守恒,则: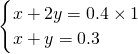
解得x=0.2,y=0.1,
故所得溶液中HCO3-和CO32-的物质的量浓度之比约0.2mol:0.1mol=2:1,
故答案为:C;
②
A.取a克混合物充分加热,在干燥器中冷却至室温,减重b克,由于碳酸氢钠分解导致固体质量减轻,根据差量法可以计算碳酸氢钠的质量,可以测定混合物中Na2CO3质量分数,故A正确;
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体,最终固体为NaCl,令混合物碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据二者质量之和及钠离子守恒列方程可以计算x、y的值,进而根据m=nM计算碳酸钠的质量,可以测定混合物中Na2CO3质量分数,故B正确;
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克.固体增重为生成的二氧化碳及硫酸溶液中带出的水蒸气,不能确定二氧化碳的质量,不能测定混合物中Na2CO3质量分数,故C错误;
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.最终固体为碳酸钡,令混合物碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据二者质量之和及碳酸钡的质量列方程可以计算x、y的值,进而根据m=nM计算碳酸钠的质量,可以测定混合物中Na2CO3质量分数,故D正确;
故答案为:ABD;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2═2 Na2CO3+O2,
故答案为:2Na2O2+2CO2═2 Na2CO3+O2.
分析:
(1)利用过氧化钠与水反应生成氧气,然后排水量气法测定氧气的体积,进而计算Na2O2试样的纯度;
(2)由(1)分析可知,需要的药品为蒸馏水;
装置的组装顺序:固体混合物与水反应,用排水量气法测定氧气的体积,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积;
(3)过氧化钠与是反应生成氢氧化钠与氧气,氧化钠与水反应生成氢氧化钠;
(4)
①令碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据钠离子守恒、碳元素守恒解方程计算x、y的值;
②
A.由于碳酸氢钠分解导致固体质量减轻,根据差量法可以计算碳酸氢钠的质量,测定混合物中Na2CO3质量分数;
B.最终固体为NaCl,令混合物碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据二者质量之和及钠离子守恒列方程可以计算x、y的值;
C.固体增重为生成的二氧化碳及硫酸溶液中带出的水蒸气,不能确定二氧化碳的质量;
D.最终固体为碳酸钡,令混合物碳酸氢钠、碳酸钠的物质的量分别为xmol、ymol,根据二者质量之和及碳酸钡的质量列方程可以计算x、y的值;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气.
点评:本题考查学生对实验原理的理解、实验方案的评价、化学计算等,综合性较大,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:辽宁省锦州市2010-2011学年度高二第一学期期末考试化学试题 题型:058
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠
溶液时,选择酚酞作指示剂.请填写下列空白:
(1)配制待测液:用5.0 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制
1000 mL溶液.除烧杯和玻璃棒外,还需要的玻璃仪器有________、________.
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到因加入一滴盐酸后,溶液由红色变为无色,并且半分钟内不恢复红色为止.读数:若滴定开始和结束时,酸式滴定管中的液面如下图所示,则起始读数为________mL,终点读数________mL.

(3)数据处理:某学生根据三次实验分别记录有关数据如下:

请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:
c(NaOH)=________.
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①若酸式滴定管尖嘴部分滴定前无气泡,滴定终了有气泡,测得的氢氧化钠溶液的浓度将________.
②若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将________.
查看答案和解析>>
科目:高中化学 来源:辽宁省期末题 题型:实验题


查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市怀柔区高一(上)期末化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com