
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ
C. 436 kJ D.188 kJ
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在一定条件下,RO3n-和F2可发生如下反应:RO3n-+ F2 + 2OH-= RO4- + 2F- + H2O从而可
知,在RO3n-中元素R的化合价是( )
A.+4 B.+5 C.+6 D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
如下表所示为自然界中的多种铜矿石的主要成分:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
请回答:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 (填化学式)
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程包含反应:
2Cu2O+Cu2S 6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是
6Cu+SO2↑,则该反应的氧化剂与还原剂的物质的量之比是
(3)火法溶炼工艺生产铜的尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中一种酸和一种盐的名称或化学式  、 。
、 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱式碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中加热⊿H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热
 H=2×(-57.3) kJ/mol
H=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) 2CO(g)+O2(g)反应的⊿H=2×283.0 kJ/mol
2CO(g)+O2(g)反应的⊿H=2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)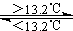 Sn(s、白) △H3=+2.1kJ/mol
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①101kPa时,2C(s)+O2(g)==2CO(g);ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语正确的是( )
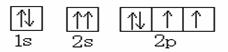 |
A.O原子的轨道表示式为
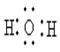 |
B.H2O的电子式为
C.Ca原子的电子排布式为 1s22s22p63s23p63d2
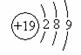 |
D.K原子的原子结构示意图为
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体化合物A不导电,但熔化或溶于水能完全电离。下列关于A的说法中,正确的是( )
A.A可能是共价化合物 B.A与金刚石的晶体类型相同
C.A中不可能有共价键 D.A溶于水中时一定破坏了A中的离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H= -359.8 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H= -556.0 kJ·mol-1
③ H2O(g)=H2O(l) △H= -44.0 kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com