
碳及其化合物应用广泛。
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
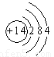
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图__________。
(2)向1L恒容密闭容器中注人CO和H2o(g),830℃时测得部分数据如下表。则该温度下反应的平衡常
数K=______________。

(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
II.已知CO(g)+1/2 O2 (g)=CO2 (g)????????????? △H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g)??????????????????????? △H=一484 kJ·mol-1
CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)????????? △Hl=一726 kJ·mol-1
(4)利用CO、H2化合制得液态甲醇的热化学方程式为___________。
III.一种新型氢氧燃料电池工作原理如下图所示
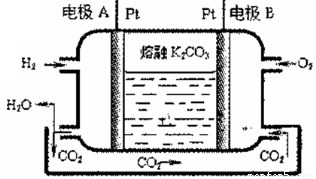
(5)写出电极A的电极反应式_____________。
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通人O2的体积为_____L(标准状况)。
(1) (2分)
(2分)
(2)1 (3分)
(3)< (2分)
(4)CO(g) + 2H2(g)=CH3OH(l)??? △H=+101 kJ/mol?? (方程式对给1分,共3分)
(5)H2-2e-+ CO32- =CO2 + H2O (3分)? (6)2.24 (2分)
【解析】
试题分析:(1)硅因素位于第三周期第ⅣA族,因此原子结构示意图为 。
。
(2)根据表中数据可知,平衡时CO和水蒸气的浓度分别是0.080mol/L和0.180mol/L,其中消耗CO的浓度是0.200mol/L-0.080mol/L=0.120mol/L,因此根据方程式可知生成CO2和氢气的浓度均是0.120mol/L,实验该温度下反应的平衡常数K=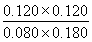 =1。
=1。
(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,则此时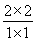 =4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。
=4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。
(4)已知① CO(g)+1/2 O2 (g)=CO2 (g)? △H=一141 kJ·mol-1、② 2H2(g)+ O2(g)=2H2O(g)? △H=一484 kJ·mol-1、③ CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)? △Hl=一726 kJ·mol-1,则根据盖斯定律可知①+②-③即得到CO、H2化合制得液态甲醇的热化学方程式为CO(g) + 2H2(g)=CH3OH(l)??? △H=+101 kJ/mol。
(5)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应。则根据装置图可知,氢气在A电极通入,因此A电极是负极,由于电解质是熔融的碳酸钾,而原电池中阴离子向负极移动,所以负极电极反应式为H2-2e-+ CO32- =CO2 + H2O。
(6)电解池中氯离子放电生成氯气,电极反应式为2Cl-2e-=Cl2↑,所以生成0.2mol氯气转移电子的物质的量是0.4mol。氧气在反应中得到4个电子,因此根据得失电子守恒可知消耗氧气的物质的量是0.4mol÷4=0.1mol,在标准状况下的体积是2.24L。
考点:考查原子结构示意图、平衡常数、热化学方程式、电化学原理的应用与有关计算


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
| 光照/叶绿素 |
| ||
| △ |
| ||
| △ |
| ||
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com