

分析 富钒炉渣(主要成分为V2O5、Fe2O3和SiO2等)加氧气和NaCl焙烧,生成含有杂质的偏钒酸钠,用水溶解,过滤,滤液中加氯化铵和硫酸生成偏钒酸铵和氯化钠,过滤,滤渣为偏钒酸铵,滤液为氯化钠溶液,煅烧偏钒酸铵生成氨气和五氧化二钒,氨气用盐酸吸收可以得到氯化铵;
(1)根据流程分析判断;
(2)焙烧时V2O5与NaCl、氧气反应生成偏钒酸钠和氯气;用Na2CO3代替NaCl与富钒炉渣焙烧制得偏钒酸钠和二氧化碳;
(3)根据NH4VO3在焙烧时质量变化的图象进行解答;
(4)已知离子方程式为2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O,根据H2C2O4的物质的量求出VO2+的物质的量,再求出V2O5的质量和质量分数;
(5)V2O5具有强氧化性,能与盐酸反应生成Cl2和VO+,根据得失电子守恒和原子守恒配平方程式;根据方程式计算.
解答 解:富钒炉渣(主要成分为V2O5、Fe2O3和SiO2等)加氧气和NaCl焙烧,生成含有杂质的偏钒酸钠,用水溶解,过滤,滤液中加氯化铵和硫酸生成偏钒酸铵和氯化钠,过滤,滤渣为偏钒酸铵,滤液为氯化钠溶液,煅烧偏钒酸铵生成氨气和五氧化二钒,氨气用盐酸吸收可以得到氯化铵;
(1)由流程分析可知,该工艺可循环利用的物质有NaCl、NH4Cl;
故答案为:NaCl、NH4Cl;
(2)焙烧时V2O5与NaCl、氧气反应生成偏钒酸钠和氯气,其反应的方程式为:2V2O5+4NaCl+O2=4NaVO3+2Cl2↑;用Na2CO3代替NaCl与富钒炉渣焙烧制得偏钒酸钠和二氧化碳,反应中没有氯气生成,不会污染环境;
故答案为:2V2O5+4NaCl+O2=4NaVO3+2Cl2↑;无Cl2产生,不污染环境;
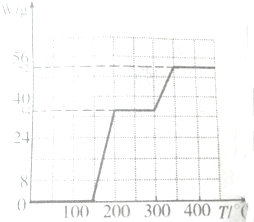
(3)根据NH4VO3在焙烧变化的图象可知:
2NH4VO3═V2O5+2NH3↑+H2O
234g 34g 18g
减少值开始为0~34g,曲线到200℃时曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少18g时就不再变化,所以NH4VO3在焙烧过程中200℃时左右先失去氨;在300~350℃再失去水,故a正确;
故答案为:a;
(4)准确称取产品V2O5 2.0g,加入足量的稀硫酸使其完全生成(VO2)2SO4,并配成250ml溶液.取25.00ml溶液用0.1000mol/L的H2C2O4溶液滴定,消耗标准液10.00ml,已知离子方程式为2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O,
则n(VO2+)=2n(H2C2O4)=2×0.01L×0.1000mol/L,
所以250ml溶液中n(VO2+)=2×0.01L×0.1000mol/L×$\frac{250mL}{25mL}$=0.02mol,所以n(V2O5)=0.01mol,其质量为0.01mol×182g/mol=1.82g,
所以产品的纯度为$\frac{1.82}{2}$×100%=92%;
故答案为:92%;
(5)V2O5具有强氧化性,能与盐酸反应生成Cl2和VO+,其反应的离子方程式为:V2O5+4Cl-+6H+=2VO++2Cl2↑+3H2O;高锰酸钾与盐酸反应生成氯气方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,则分别生成1mol氯气消耗V2O5、KMnO4的物质的量之比为0.5mol:0.4mol=5:4;
故答案为:5:4.
点评 本题考查实验制备方案、氧化还原反应滴定及计算、物质的分离提纯、对条件与操作的分析评价,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )
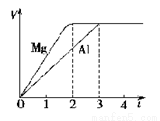
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
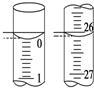 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
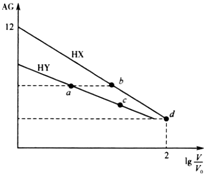 常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | a、b溶液中导电离子数目相等 | |
| B. | 水的电离程度:a<b<c | |
| C. | d点所示溶液的AG=8 | |
| D. | 与等浓度的NaOH溶液中和时,c点消耗NaOH溶液的体积大于a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
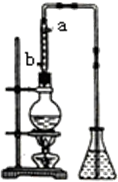 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.秦朝铜车马 | B.春秋越王剑 | C.唐三彩 | D.商代司母戊鼎 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com