
| ��� | ������ | ��ԭ�� | ������Ӧ�� | �������� | ��ԭ���� |
| �� | Cl2 | FeBr2 | Cl- | ||
| �� | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| �� | KClO3 | Ũ���� | Cl2 |
| A�� | ���Т���ķ�Ӧ������һ�ֻ�����Ԫ�ر����� | |
| B�� | ������Ӵ���ıȽϣ�KClO3��Fe3+��Br2��Cl2 | |
| C�� | ���Т��鷴Ӧ�Ļ�ԭ������KCl������ת����Ŀ��6e | |
| D�� | ���Т��鷴Ӧ�Ļ�ѧ����ʽΪ��2KMnO4+3H2O2+3H2SO4��2MnSO4+K2SO4+4O2��+6H2O |
���� A���������Ӻ������Ӷ����Ա�����������
B���������������Դ����������
C�����ݷ�Ӧ�л��ϼ۵ı仯���������ԭ��Ӧ�ĸ�������жϣ�
D������������ԭ��Ӧ�ĵ����غ㣬����غ㣬ԭ���غ���д�ж����ӷ���ʽ��
��� �⣺A�������������ӵĻ�ԭ�Դ��������ӣ���������˳�����������Ա��Т���ķ�Ӧ������һ�ֻ�����Ԫ�ر���������A��ȷ��
B��������ԭ��Ӧ���������������Դ��������������Cl2��Fe3+��Cl2��Br2 ��KClO3��Cl2 ��KMnO4��O2���õ�KClO3��Cl2��Fe3+��Br2 ��B����
C����Ӧ�ۻ�ԭ�����ԭ�����Ϊ������KClO3+6HCl=KCl+3Cl2��+3H2O������ת��5e-����C����
D�����鷴Ӧ�����ӷ���ʽΪ��2MnO4-+5H2O2+6H+=2Mn2++5O2��+8H2O����D����
��ѡA��
���� ���⿼����������ԭ��Ӧ���ӷ���ʽ��Ӧ�ú�ע�����⣬��Ҫ����������ԭ��Ӧ�ķ�Ӧ˳���жϣ�������ԭ��Ӧ�ĸ���Ӧ�ã������غ��Ӧ�ü��㣬���ӷ���ʽ����д��������Ŀ�Ѷ��еȣ�


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
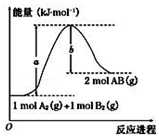
| A�� | ÿ���� 2 ������ AB ���գ�a-b�� kJ ���� | |
| B�� | �÷�Ӧ�ȡ�H=+��a-b��kJ•mol-1 | |
| C�� | �淴Ӧ�Ļ�ܸ�������Ӧ�Ļ�� | |
| D�� | ����1mol A-A �� 1mol B-B �����ų� a kJ ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ | B�� | ����ά����C | C�� | ������ţ�� | D�� | ��ʳ�ô� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������۱���ɫ�������⡱ָ��Ԫ�� | |
| B�� | Ϊ�˲��⣬Ҫ��ʳ�ú��ߵ����ʳ�� | |
| C�� | ��ˮ�м���CCl4��ֻ�Ϻ��÷ֲ㣮CCl4���²㣬�����Ϻ�ɫ�������̫��ʵ�����л��������Һ�壬CCl4��δ�����²� | |
| D�� | ͨ����ȡ�������ա��ܽ�����ˡ���ȡ���ɴӺ�������ȡ���ʵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CuO��Cu | B�� | Fe��FeCl2 | C�� | H2SO4��CuSO4 | D�� | HNO3��NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com