
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B.常温常压下,22.4L CH4含有4NA个C—H共价键 |
| C.2mol N2与2mol H2混合充分反应,转移的电子数目为4NA |
| D.10L pH=1的硫酸溶液中含有的H+离子数为2NA |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 L 0.1 mol·L-1的氨水中含有的NH3·H2O分子数为0.1 NA |
| B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2 NA |
| C.标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2 NA |
| D.一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若nA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,5.6LCCl4含有的C-Cl共价键数为nA |
| B.2.4gMg与足量稀硫酸反应时,失去电子数为0.1nA |
| C.l L0.5mol. L-1CuCl2溶液中含有的Cu2+数为0.5 nA |
| D.16g氧气和臭氧的混合物中氧原子数为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.标准状况下,2.24LNH3中含有6.02×1022个N—H共价键 |
| B.100 mL 1 mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C.将4gNaOH溶于100g蒸溜水,所得溶液物质的量浓度是1.0mol/L |
| D.将7.8gNa2O2放入足量的水中,反应时转移6.02×1022个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设nA为阿伏加德罗常数的值,下列说法正确的是(相对原子质量:C-l2 H-1)
| A.2.24L NO2含有0.2nA个氧原子 |
| B.常温常压下,C2H4和C3H6组成的28g混合气体中含4nA个氢原子 |
| C.1 molC2H6分子中含有7nA个极性键 |
| D.常温下pH=13的NaOH溶液中含有的0.1 nA个OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设nA是阿伏加德罗常数的数值,下列说法正确的是
| A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5nA |
| B.4.2 g丙烯中所含的共价键数目为0.6nA |
| C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 nA |
| D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 nA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用下图装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示。
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.5g | 140.0g |
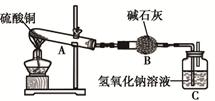
 3CuO + SO3↑ + 2SO2↑ + O2↑
3CuO + SO3↑ + 2SO2↑ + O2↑ 4CuO + 2SO3↑ + 2SO2↑ + O2↑
4CuO + 2SO3↑ + 2SO2↑ + O2↑ 5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
5CuO + SO3↑ + 4SO2↑ + 2O2 ↑ 6CuO + 4SO3↑ + 2SO2↑ + O2↑
6CuO + 4SO3↑ + 2SO2↑ + O2↑查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。 正极 ,负极 ,电解质溶液 ,电极反应式 、 。
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A 称量的是长期暴露在空气中的NaOH
B 容量瓶不干燥
C 将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制。
D 混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com