
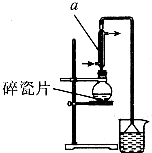
 ������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�
������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�| �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | |
| ������ | -89.53 | 117.25 | 0.81 |
| 1-�嶡�� | -112.4 | 101.6 | 1.28 |
���� ��1���������ṹ��֪AΪֱ�������ܣ���Ӧ����ʱ���¶Ȳ��˳���100�棬��ȡˮԡ���ȣ����Ƭ���Է�ֹ����ʱ���У��廯�⼫������ˮ��������
��2������Ũ����Ĵ�������ˮ����ϩ���ѣ�Br-��Ũ��������ΪBr2�ȣ�Ũ�������ջ���ȣ�����ʹHBr�ӷ���
��3����ȡ������õ�1-�嶡�飬����Ҫ���������ƾ��Ƽ�������ƿ��
��4����������¶ȸ���101.6�棬����117.25�棬���¶���ˮ���γ�ˮ������
��5��1-�嶡�鲻����ˮ���ܶȱ�ˮ��
��6����������������1-�嶡������۲���������=$\frac{ʵ�ʲ���}{���۲���}$��100%��
��� �⣺��1���������ṹ��֪AΪֱ�������ܣ���Ӧ����ʱ���¶Ȳ��˳���100�棬�Ϻõļ��ȷ����Dz�ȡˮԡ���ȣ��Ϻõļ��ȷ��������Ƭ���Է�ֹ����ʱ���У��廯�⼫������ˮ��װ���е���©���������ǣ�
�ʴ�Ϊ��ֱ�������ܣ�ˮԡ���ȣ���ֹ���У���ֹ�廯�⼫������ˮ��������
��2��a��Ũ�����1-������Ӧ������ȥ��Ӧ����ϩ�������Ӽ���ˮ��Ӧ�����ѣ�ϡ�ͺ��ܷ������Ʒ�Ӧ���ٸ�����ϩ���ѵ����ɣ���a��ȷ��
b��Ũ�������ǿ�������ܽ�����������Ϊ�嵥�ʣ�ϡ��Ũ������ܼ���Br2�����ɣ���b��ȷ��
c����Ӧ��Ҫ�廯���1-������Ӧ��Ũ�����ܽ���Һ�¶����ߣ�ʹ�廯��ӷ���ϡ�ͺ����HBr�Ļӷ�����c��ȷ��
d��ˮ�Dz��ﲻ�Ƿ�Ӧ�Ĵ�������d����
��ѡ��abc��
��3����ȡ������õ�1-�嶡�飬����װ�ó����õ������ܡ��¶ȼơ�ţ�ǹܡ���ƿ������Ҫ�IJ��������Ǿƾ��ơ�������ƿ��
�ʴ�Ϊ���ƾ��ơ�������ƿ��
��4����������¶ȸ���101.6�棬����117.25�棬���¶���ˮ���γ�ˮ���������ܺ��е�������Ҫ��ˮ��
�ʴ�Ϊ��ˮ��
��5��1-�嶡�鲻������ˮ�����ܶȴ���ˮ�����Խ�1-�嶡��ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã��������²㣬
�ʴ�Ϊ���²㣻
��6��7.4g�������淴Ӧ����1-�嶡������Ϊm����
C4H9-OH+HBr$\stackrel{��}{��}$ C4H9-Br+H2O
74 137
7.4g 13.7
�����Ƶ�1һ�嶡��9.6g����1-�嶡��IJ���=$\frac{9.6g}{13.7g}$��100%��70%��
�ʴ�Ϊ��70%��
���� ���⿼���л����Ʊ�ʵ�飬�漰��װ��������ķ������ۡ�ʵ�������������ԭ���ķ������ۡ����ʼ���ȣ�ע�����Ŀ��Ϣ�����ݵ�Ӧ�ã��ϺõĿ�����ѧ���������⡢���������������Ѷ��еȣ�


 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH+HCl�TNaCl+H2O | B�� | 2Al+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3 | ||
| C�� | SO3+H2O�TH2SO4 | D�� | NH4HCO3 $\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ȼ�� | B�� | ���ȷ�Ӧ | C�� | Һ������ | D�� | ����к� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mg��OH��2 | 9.9 | 11.1 |
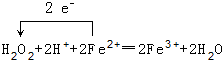 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
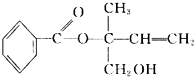
| A�� | �л���M����֬������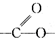 �����������Ի���������¶��ܷ���ȡ����Ӧ �����������Ի���������¶��ܷ���ȡ����Ӧ | |
| B�� | M��һ���������ܷ����Ӿ۷�Ӧ�����ܷ���������Ӧ | |
| C�� | ��Ni�������������£�1 mol M���ֻ����1molH2�ӳ� | |
| D�� | ���������Ը��������Һ���ֱ���M |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
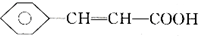 �����̶��ϳ�H��·�����£�
�����̶��ϳ�H��·�����£�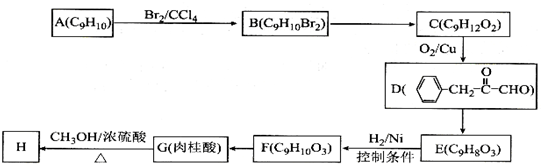
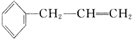 ��D�к��й����ŵ�����Ϊ�ʻ���ȩ����
��D�к��й����ŵ�����Ϊ�ʻ���ȩ���� +CH3OH$?_{��}^{Ũ����}$
+CH3OH$?_{��}^{Ũ����}$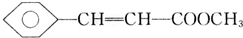 +H2O��
+H2O��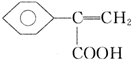 ��
��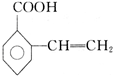 ��
�� ��
��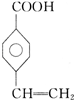 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 400 | 500 | 800 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ƫ��������Һ�м���������AlO2-+4H+=Al3++2H2O | |
| B�� | MnO2��Ũ�����ϼ��ȣ�MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O | |
| C�� | ��Ũ�ȵ������Ba��OH��2��Һ��NaHSO4��Һ��ϣ�Ba2++OH-+H++SO42-=BaSO4��+H2O | |
| D�� | ��NaOH��Һ��������H2S���壺OH-+H2S=HS-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com