
| A. | 英国道尔顿----提出元素概念 | |
| B. | 法国拉瓦锡----提出原子学说 | |
| C. | 俄国门捷列夫---发现元素周期律 | |
| D. | 英国波义耳----建立燃烧现象的氧化学说 |
科目:高中化学 来源: 题型:实验题
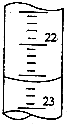 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两烧杯中参加反应的锌粒等量 | |
| B. | 反应开始时产生H2的速率相等 | |
| C. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大 | |
| D. | 甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 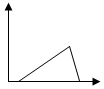 | D. | 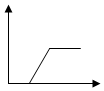 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水的质量约为18g | |
| B. | 22.4LN2含6.02×1023个氮气分子 | |
| C. | 2gH2占有的体积约为22.4L | |
| D. | 22g二氧化碳与标准状况下11.2LHCl气体含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,氯气的摩尔体积为22.4L•mol-1 | |
| B. | 将标准状况下11.2L的HCl溶于1.0L的水中,所得溶液中HC1的浓度为O.5mol/L | |
| C. | 常温常压下,等体积的CO和H2的质量比为1:1 | |
| D. | 物质的摩尔质量在数值上等于其相对分子质量或相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com