
(11分) 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如右图所示。
已知:
① 甲、乙、丙均为前三周期元素的单质,常温下均为气体,丁是日常生活中的一种常见金属。
② 常温下,X是无色液体,Y是黑色固体。
③ 丙在乙中燃烧发出苍白色的火焰,W的水溶液呈黄色。
请回答:
(1)写化学式:甲_____________, Z_____________。
(2)丁与X在高温下也能得到Y,请写出该反应的化学方程式
___________________________________________________。
(3)将少量W的溶液滴入几滴KSCN溶液,迅速变为红色,请写出该反应的化学方程式____________________________________________________。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H,将H滴入品红后,溶液的颜色逐渐褪去,加热后溶液为 (填颜色)。
(5)将Y恰好溶于Z的水溶液后,检验其中低价金属离子的方法是滴入酸性KMnO4,紫色褪去,说明有该离子,仔细分析后发现该结论存在缺陷,此“缺陷”是 。
(1) O2,HCl (2) 3Fe + 4H2O![]() Fe3O4 + 4H2
Fe3O4 + 4H2
(3) Fe3++ 3SCN-= Fe(SCN)3 (4) 无色
(5) 在酸性条件下,Cl-也能将MnO4-还原,使其褪色
解析:(1)无机推断题,要找准“题眼”,本题中③可作为切入点,丙在乙中燃烧发出苍白色的火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
(2)丁与X在高温下也能得到Y的化学方程式为3Fe +4H2O![]() Fe3O4 + 4H2
Fe3O4 + 4H2
(3)Fe3+遇SCN-显红色,可以用来检验Fe3+,离子方程式为Fe3++ 3SCN-= Fe(SCN)3。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H2O2,H2O2具有强氧化性,能使品红褪色,加热,不能恢复,所以溶液最终无色。
(5)酸性KMnO4可以氧化Fe2+,同时也能氧化Cl-。所以酸性KMnO4紫色褪去,不能验证溶液中一定存在Fe2+。


科目:高中化学 来源:山东省胜利油田一中2012届高三下学期第一次调研考试化学试题 题型:022
甲、乙、丙、丁是由前20号元素组成的物质,以下4种情况下的反应均符合转化关系:甲+乙→丙+丁.请按要求回答下列问题:
(1)若甲和丁是同主族元素组成的单质,且甲的组成元素位于第三周期;乙为水.
①则丙的电子式为________;
②该反应的离子方程式为________.
(2)若甲为固态离子化合物,组成它的两种元素的核电荷数之和为26;乙为水;丙为分于内既含有非极性键又含有极性键的可燃性气体.
①则丙的结构式为________;
②丁的稀溶液与盐酸反应生成1 mol水时放热为X kJ,请写出此反应的热化学方程式________.
(3)若常温下气体甲的水溶液pH大于7;乙为黄绿色气体;丙为无色气体单质,丁为固体铵盐.假设充满甲、乙两种混合气体在集气瓶中恰好完全反应,冷却后再将该集气瓶倒置于水中打开塞子,观察水倒吸入集气瓶中,剩余气体占反应前气体总体积的1/11.
①在甲与乙的反应中,甲具有(填“氧化”或“还原”)________性;
②还可以观察到集气瓶中的现象有________,其中反应的化学方程式为________.
(4)若甲为黄绿色气体单质;乙为固体氧化物,常用作肥料,其水溶液pH<7;丙为氮的氯化物;丁为HCl.当消耗6.72 L Cl2(标准状况下)时得到0.10 mol丙.
①用离子方程式表示乙的水溶液pH<7的原因:________.
②请写出该反应的化学方程式________.
查看答案和解析>>
科目:高中化学 来源:2012届高三上学期化学一轮复习《从矿物到基础材料》专题综合测试(苏教版) 题型:单选题
(11分)某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:
(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是_______________________。
在灼烧操作中用到下列仪器中的一种,其名称是________。
(2)写出步骤①中发生反应的离子方程式____________________________________
________________________________________________________________________。
(3)操作③中洗涤如何操作_______________________________________________
________________________________________________________________________。
(4)甲同学在实验室中用下列装置制备CO2气体,并通入滤液B中制取Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2不足是导致实验失败的原因之一。你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因________________________________________________________。
(若你认为不合理,该空不作答)
丙同学分析认为:甲同学通入的CO2中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置可解决这个问题。请帮助该同学画出该装置图,并注明试剂名称。
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修4 3.2水的电离和溶液的酸碱性练习卷(解析版) 题型:选择题
(12分)有甲、乙两份等体积的浓度均为0.1 mol/L的氨水,pH为11.
(1)甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡将向______(选填“促进”或“抑制”)电离的方向移动,溶液的pH将为______(选填序号).
A.9~11之间 B.11
C.12~13之间 D.13
(2)乙用0.1 mol/L的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH______(选填“甲大”“乙大”或“相等”),其原因是__________________________
________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(11 分)已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。

请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某医学杂质上用图11-9表示甲、乙两种物质的结构简式,这两种结构简式虽不是很符合有机物结构简式的书写规范,但还是能够清楚地表示甲、乙两种物质的结构特征。
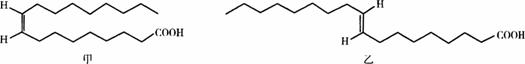
图11-9
请根据你所学过的化学知识回答下列问题:
(1)写出甲的分子式___________,甲和乙可互称为___________(填“同系物”或“同分异构体”)。你认为甲、乙两种哪一种是反式脂肪酸?___________。
(2)你认为甲、乙两种物质能否在空气中燃烧?___________,若你认为能够燃烧,请写出甲在足量氧气中燃烧的化学方程式:_________________________________。
(3)顺式脂肪酸多为液态,空间呈弯曲状,反式脂肪酸多为固态,空间呈线型。血液中反式脂肪酸含量过高,易使溶液堵塞血管而导致心脑血管疾病。原因是_________________________。
(4)在油脂催化氢化(如制备人造奶油、酥油)过程中,构型会发生变化。另外,油脂长时间高温加热,也会产生反式脂肪酸。若ag甲转化成乙吸收QkJ热量,写出该热化学反应方程式:___________(用“甲”、“乙”表示物质分子式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com