
| A������M����ˮ��Ӧ����X���ʺ�һ��ǿ�� |
| B��Z���ʵı�Ƭ�ھƾ����ϼ������ۻ����������� |
| C��Y������������Ӧ��ˮ�������N��������ˮ�ĵ��� |
| D��M��N�о��������Ӽ����ۼ� |


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
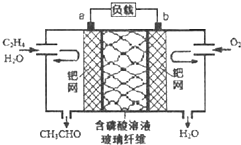 ��ϩ����������ȩ����Ƴ���ͼ��ʾ��ȼ�ϵ�أ������Ʊ���ȩ��ͬʱ��õ��ܣ����ܷ�ӦΪ��CH2=CH2+O2��2CH3CHO�������й�˵����ȷ���ǣ�������
��ϩ����������ȩ����Ƴ���ͼ��ʾ��ȼ�ϵ�أ������Ʊ���ȩ��ͬʱ��õ��ܣ����ܷ�ӦΪ��CH2=CH2+O2��2CH3CHO�������й�˵����ȷ���ǣ�������| A���õ��Ϊ�ɳ���� |
| B��ÿ��0.1mol O2��Ӧ����Ǩ��H+0.4mol |
| C��������ӦʽΪ��CH2=CH2-2e-+2OH-�TCH3CHO+H2O |
| D�������ƶ����缫a��������Һ���缫b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
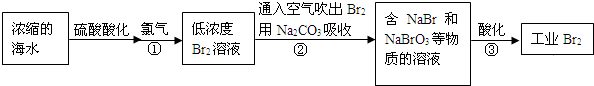
 �������糧�ͷų������������NOx����SO2��CO2���������ɻ������⣮��ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ģ�
�������糧�ͷų������������NOx����SO2��CO2���������ɻ������⣮��ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ģ�| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ع��͡������ܻ��������ڱ��������������ʣ������ڸ߷��ӻ�������Խ����к� |
| B��������ˮʱ�����˻�ѧ�������仯������ɱ�������������� |
| C�������Ѿƴ���ʱ�䳤���������Ϊ�Ҵ�������������Ӧ |
| D�����ơ����Ƚ���Ԫ�ص�������Ѥ������ɫ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� | HA���ʵ���Ũ�ȣ�mol?L-1�� | NaOH���ʵ���Ũ�ȣ�mol?L-1�� | �����Һ��pH |
| �٢ڢ� | 0.1 | 0.1 | pH=9 |
| C | 0.2 | pH=7 | |
| 0.2 | 0.1 | pH��7 |
| A��HA�ĵ��뷽��ʽΪ��HA?H++A- |
| B���������������ʵ������c��0.2 |
| C������ʵ���У������Һ��c��A-����c��Na+����c��HA����c��H+����c��OH-�� |
| D������ʵ���У������Һ��c��A-��=��0.1+10-9-10-5��mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
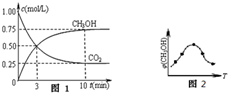
 ��CO2��һ����������H2��Ӧת��Ϊ�״���CH4O���DZ��Ϊ���ĺ÷�����һ�������£�ÿת��1kg CO2�ų�������Ϊ1113.64KJ��CO2ת��Ϊ�״�������Ũ����ʱ��ı仯������ͼ��ʾ����֪��Ӧ����������ڴ������¾�Ϊ���壩��������������ȷ���ǣ�������
��CO2��һ����������H2��Ӧת��Ϊ�״���CH4O���DZ��Ϊ���ĺ÷�����һ�������£�ÿת��1kg CO2�ų�������Ϊ1113.64KJ��CO2ת��Ϊ�״�������Ũ����ʱ��ı仯������ͼ��ʾ����֪��Ӧ����������ڴ������¾�Ϊ���壩��������������ȷ���ǣ�������| A���ڽ��е�3����ʱ��CO2��H2������ķ�Ӧ����ֵ��ȣ���Ϊ0.5mol?L-1?min-1 | ||
| B���˷�Ӧ���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��?CH4O��g��+H2O��g����H=-49.0KJ/mol | ||
C���������·�Ӧ��ƽ�ⳣ��Ϊ
| ||
| D�������¶ȣ��˷�Ӧ��ƽ�ⳣ������Ϊ0.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ױ��DZ�����������ϩ�Dz������� |
| B��ʯ�͵��ѻ���Ʒ��ʹ��ˮ��ɫ |
| C����������CuSO4��Һ�з������� |
| D����֬��NaOH��Һ��ˮ�����ɸ�֬������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ϻ���Һ�д����й�ϵ��C��K+��+C��Na+��+C��H+��=C��SO32-��+C��HSO3-��+C��OH-�� |
| B����Ϻ���Һ�д����й�ϵ��C��K+��+C��H2SO3��+C��H+��=C��SO32-��+C��OH-�� |
| C����Ϻ���Һ�д����й�ϵ��C��SO32-��+C��HSO3-��+C��H2SO3��=0.02 mol?L-1 |
| D������Һ���ǰ��Na2SO3��Һ��ˮ�����C��H+��С��KHSO3��Һ��ˮ�����C��H+�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com