
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 7 |
| ||
查看答案和解析>>
科目:高中化学 来源:广西南宁沛鸿民族中学2010-2011学年高二下学期期中考试化学文科试题 题型:058
在实验室里模拟用N2和H2合成氨,现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验.
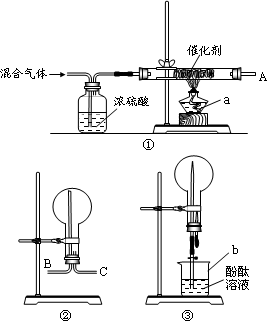
请回答下列问题:
(1)实验仪器a、b的名称分别是________、________.
(2)装置①中浓硫酸的作用是________.
(3)如果用装置②收集反应生成的气体,管口A应接装置中的________(填“B”或“C”)口,收集到的气体成分是________.
(4)收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈________色.
(5)实验结束时,若测得溶液的体积为烧瓶容积的![]() ,则在合成氨过程中N2的转化率为________.(
,则在合成氨过程中N2的转化率为________.(![]() )
)
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 7 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com