
分析 ①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②0.08mol气体为氨气,溶液中一定含有NH4+,并且物质的量为0.08mol;
③4.66g沉淀为硫酸钡,12.54g沉淀为硫酸钡和碳酸钡的混合物;
再根据电荷守恒,得出一定存在钾离子,据此进行解答.
解答 解:①第一份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生的离子有:Cl-、CO32-、SO42-;
②加足量NaOH溶液加热产生气体,气体是氨气,故一定有铵离子0.04mol,溶液中一定含有NH4+,并且物质的量为0.04mol;
③不溶于盐酸的4.66g为硫酸钡,物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为:$\frac{7.88g}{197g/mol}$=0.04mol,故原溶液中一定存在CO32-、SO42-,则一定没有Mg2+、Ba2+;
再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.08mol;c(-)=2c(CO32-)+2c(SO42-)=0.12mol,正电荷总物质的量大于负电荷,故原溶液中一定有K+,至少为0.04mol;
综合以上可以得出,一定存在的离子有:NH4+、K+、CO32-、SO42-,一定没有的离子Mg2+、Ba2+,可能存在Cl-;
(1)由第一份进行的实验推断该混合物是否一定含有Cl-,不能,因为生成碳酸银和硫酸银也有白色沉淀,故答案为:否;
(2)由第二份进行的实验可知混合物中应含NH4+,其物质的量为0.08mol,浓度为0.08mol÷0.1L=0.8 mol/L;
(3)不溶于盐酸的4.66g为硫酸钡,物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,可知溶液里n(SO42-)=0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为:$\frac{7.88g}{197g/mol}$=0.04mol,可知溶液里n (CO32-)=0.04mol,故答案为:BaCO3、BaSO4;n (CO32-)=0.04mol、n(SO42-)=0.02mol;
(4)结合分析可知原溶液里一定存在的离子有:NH4+、K+、CO32-、SO42-,一定没有的离子Mg2+、Ba2+,可能存在Cl-,再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.08mol;c(-)=2c(CO32-)+2c(SO42-)=0.12mol,正电荷总物质的量大于负电荷,故原溶液中一定有K+,至少为0.04mol,选项A正确,故答案为:A.
点评 本题考查常见阴、阳离子的检验方法,题目难度中等,注意掌握常见离子的化学性质及检验方法,本题中根据电荷守恒判断钾离子的存在为易错点,做题时需要细致分析.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
| A. | M只能是碱类 | B. | M只能是盐类 | C. | M一定为电解质 | D. | M可能为非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下不容易与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝、锌等金属钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池只能在燃烧的情况下才能发生 | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 燃料电池属于二次电池的一种 | |
| D. | 燃料电池与燃料燃烧时对能量的转化率完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
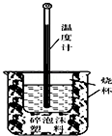 某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:
某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com