
 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
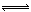 2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题

| A.该电池的正极反应式:H2O2+2H++2e—=2H2O |
| B.燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C.电池工作时,1 mol甲醇被氧化有6 mol电子转移 |
| D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
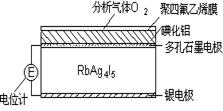
| A.Ag-e-=Ag+ | B.I2+2Ag++2e-=2AgI |
| C.I2+2Rb++2e-=2RbI | D.4AlI3+3O2=2Al2O3+6I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.构成原电池的正极和负极必须是两种不同金属 |
| B.原电池是把化学能转变为电能的装置 |
| C.在铅、银和盐酸构成的原电池工作时,铅板上有5.18 g铅溶解,正极上就有1 120 mL(标准状况)气体析出 |
| D.原电池工作时,正极和负极上发生的都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.燃料电池将化学能转化为电能 |
| B.a是甲醇、b是氧气 |
| C.质子从M电极区穿过交换膜移向N电极区 |
| D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.①②中Mg作负极,③④中Fe作负极 |
| B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ |
| C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+ |
| D.④中Cu作正极,电极反应式为2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
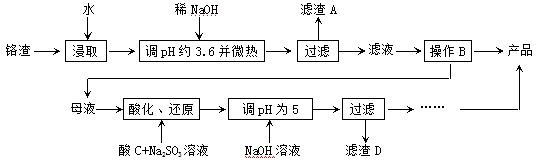
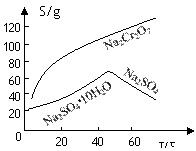
 Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com