
【题目】【化学―选修5:有机化学基础】
聚碳酸酯(PC)是一种强韧的热塑性树脂,广泛用于玻璃装配业、汽车工业、电子和电器工业。PC的一种合成路径如下:

回答下列问题:
(1)烃A 的质谱图如下,则A 的分子式为__________。

(2)D 的名称为_________,D→E的反应类型为_______。
(3)双酚的结构简式为_______。
(4)B 和E 可以形成一种酯类物质F,写出B + E→F反应的化学方程式:_______。
(5)F的同分异构体中,能同时满足如下条件的共有______种(不考虑立体异构)。
① 分子中有两个甲基;
② 能发生银镜反应;
③ 在酸性溶液中的水解产物遇FeC13 溶液显紫色。
写出其中核磁共振氢谱显示5组峰,且峰面积比为62:2:11的种分子的结构简式:_______。
(6)写出由D分子合成甘油(丙三醇)的合成路线图_______。(已知:![]() )
)
【答案】 C7H8 2-氯丙烷 取代反应 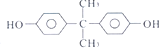
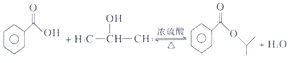 13
13 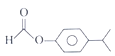

![]()
【解析】(1)92÷12=7……8,所以A的分子式为C7H8,根据产物PC的结构可知A的结构简式为![]() ,名称为甲苯。
,名称为甲苯。
(2)C3H7Cl为卤代烃,在NaOH的水溶液中发生水解生成相应的醇,醇在CuO氧化下生成(CH3)2C=O,由此可知氯原子连接在中间碳上,所以D的结构简式为(CH3)2CHCl,名称为2—氯丙烷,D到E的反应类型是取代反应或水解反应。
(3)A是甲苯,在KMnO4的氧化下生成B,B为苯甲酸,苯甲酸在一定条件下还原为C,根据C的分子式可知C为苯酚,两分子苯酚与丙酮发生反应生成双酚,丙酮中碳氧双键断开,苯酚中酚羟基对位的氢原子断裂,形成H2O,因此双酚的结构简式为: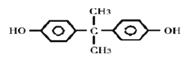 。
。
(4)B为苯甲酸,D的结构简式为(CH3)2CHCl,E的结构简式为(CH3)2CHOH,B与E发生酯化反应,化学方程式为: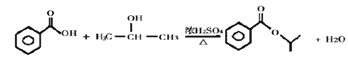 。
。
(5)F的分子式为C10H12O2,不饱和度为5,在酸性溶液中的水解产物遇FeC13溶液显紫色,
可知含有一个苯环(不饱和度为4)和一个酯基(不饱和度为1),且羟基氧连在苯环上。能发生银镜反应,含有一个醛基,根据不饱和度可知该物质只能是甲酸某酯,除去苯环和甲酸某酯上的7个碳外,还余3个碳,含有两个甲基,则有两种情况:(1)一个甲基和一个乙基分别连在苯环上,此时F结构中苯环上连着3个不同的取代基,共有10种结构;(2)苯环上连着一个异丙基-CH(CH3)2,此时F结构中苯环上连着2个取代基,共有3种结构,故符合条件的同分异构体总共有13种;根据峰峰面积比为6:2:2:1:1可知F结构中含有异丙基结构,故符合条件的同分异构体的结构为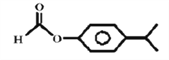 。
。
(6)比较原料2-氯丙烷和目标产物丙三醇的结构可知,官能团的种类、数目发生变化,要得到丙三醇必须先制取三氯丙烷,要使一氯丙烷转化为三氯丙烷,必须通过加成反应增加氯原子,所以先使2 –氯丙烷在NaOH的醇作用发生消去反应得到丙烯,然后在加热下取代-CH3上的一个H原子,然后再与Cl2发生加成反应,即可引入3个氯原子的卤代烃,最后水解即可,故其合成路线为: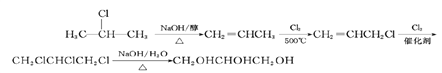 。
。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】化学在工业上的应用十分广泛。请回答下列问题:
(1)工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是(填化学式)_______。
(2)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中A1N的质量分数,进行了以下实验:称取10g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中A1N的质量分数,进行了以下实验:称取10g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①AlN跟NaOH溶液反应的化学方程式为________________________;
②该样品中的A1N的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知漂白粉与浓盐酸反应产生氯气。反应方程式为:
Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O,
某同学为了测定氯气的体积并验证干燥氯气无漂白性,现有如图装置,请回答:
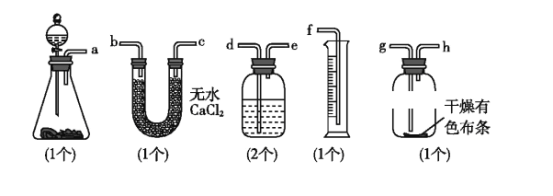
(1)请用字母填写装置的连接顺序:a接d、e接b、c接__、__接__、__接f。
(2)洗气瓶中所装液体是_______。
(3)在制氯气前,必须进行的一项操作步骤是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空。
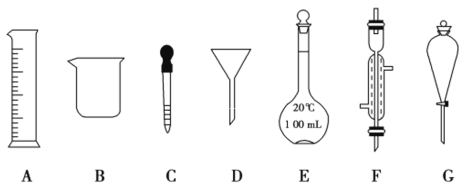
(1)写出仪器名称:F________,G________。
(2)下列实验操作中用到仪器G的是________(填下列选项的编号字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
(3)实验室配制100 mL 0.5 mol/L的盐酸。
①下列关于仪器E的使用方法中,正确的是________(填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到其中
②配制该溶液需用10 mol/L的浓盐酸________mL。
③下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.摇匀后,液面下降,补充水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二价铬不稳定,极易被氧气氧化。醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:

制备过程中发生的化学反应或离子反应:
Zn+2HCl===ZnCl2+H2↑;2CrCl3+Zn===2CrCl2+ZnCl2;
2Cr2++4CH3COO-+2H2O===[Cr(CH3COO)2]2·2H2O↓。
请回答下列问题:
(1)仪器A的名称是______________,所盛装的试剂是______________。
(2)本实验中配制溶液所用的蒸馏水都需事先煮沸,原因是______________________________________________________________。
(3)仪器D的主要作用是______________。
(4)实验生成H2后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应________(填“打开”或“关闭”,后同)阀门1、________________阀门2。
(5)本实验中锌粒须过量,其原因是_______________________。
(6)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质6.34 g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 5.64 g,所得产品的产率为________。
(7)若使用该装置制备Fe(OH)2,且能较长时间看到Fe(OH)2 白色沉淀现象。则在仪器A、B、C中应装入的试剂依次为________、________、________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、L为五种短周期元素,非金属元素X最外层电子数与其周期序数相同,Y的最外层电子数是其所在周期数的2倍。Y在Z中充分燃烧能生成其最高价化合物YZ2。W+与Z2-具有相同的电子数。X在L中燃烧,产物XL溶于水得到一种强酸。请回答下列问题:
(1)X在周期表中的位置是_____。请写出实验室制备单质L的化学方程式______,尾气处理的离子方程式____________。
(2)由X分别与Y、Z形成的最简单化合物的稳定性关系为___________________。
(3)由X、Y、Z、W组成的一种盐,在面食中有大量使用,在其水溶液中滴入由X、Y、Z形成的厨房中常见的一种酸,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是
A.X的能量一定高于MB.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定高于ND.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com