
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 ,sp2杂化电子排布图为
,sp2杂化电子排布图为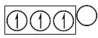 ,sp3杂化电子排布图为
,sp3杂化电子排布图为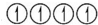 ,
, ,sp2杂化电子排布图为
,sp2杂化电子排布图为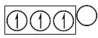 ,sp3杂化电子排布图为
,sp3杂化电子排布图为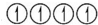 .
.


科目:高中化学 来源: 题型:
| A、Fe3+离子只具有氧化性,Fe只具有还原性 |
| B、除去FeCl2溶液中混有的少量FeCl3,最好的方法是通入氯气 |
| C、Fe2+的水溶液为浅绿色,Fe2+既有氧化性又有还原性 |
| D、Fe3+的水溶液为棕黄色,可用含SCN-的溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
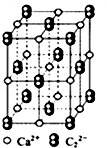 CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )| A、6.4克CaC2晶体中含阴离子0.2 mol |
| B、该晶体中的阴离子与N2是互为等电子体 |
| C、1个Ca2+周围距离最近且等距离的C22-数目为6 |
| D、与每个Ca2+距离相等且最近的Ca2+共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同条件下,1mol任何气体所含分子个数均相同 |
| B、1mol任何气体的体积均为22.4L |
| C、1mol气体在压强一定时,50℃时体积比20℃时体积大 |
| D、1LO2和1LO3在同温同压下具有相同数目的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、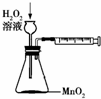 用以定量测定化学反应速率 |
B、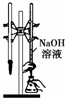 为用已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
C、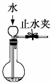 可以检查装置的气密性 |
D、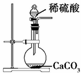 为实验室制取少量CO2的发生装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com