
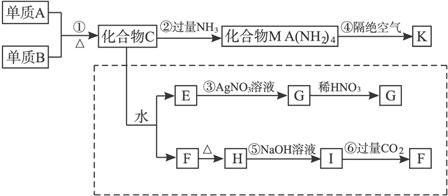
请回答下列问题:
(1)写出化学式:单质B:__________,化合物F:__________。
(2)物质H是__________晶体。
(3)写出下列反应的离子方程式:
反应③______________________________,
反应⑤______________________________,
反应⑥______________________________。
(4)写出反应②和④的化学方程式:
②___________________________________,
④___________________________________。
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
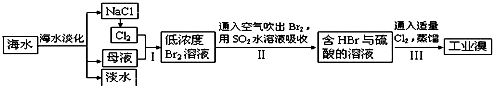
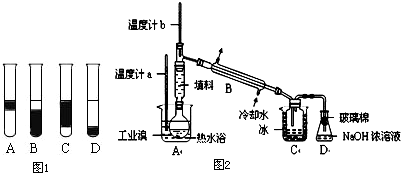
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
| ||
| ||
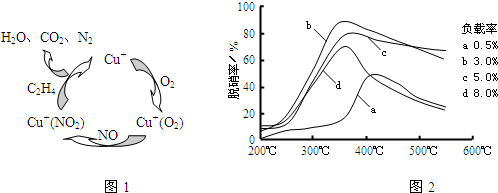
查看答案和解析>>
科目:高中化学 来源: 题型:
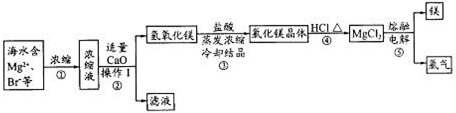
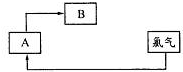
查看答案和解析>>
科目:高中化学 来源: 题型:
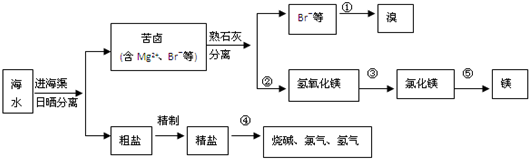
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市高三上学期期中考试化学试卷(解析版) 题型:填空题
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
|
|
|
J |
|
|
|
|
|
|
|
R |
M的气态原子逐个失去1~ 4个电子所需能量(电离能)如下表所示,
|
|
I1 |
I2 |
I3 |
I4 |
…… |
|
电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
…… |
(1)M的电子排布式为________;元素T在周期表中的位置为________。
(2)J和氢能形成多种化合物,其中分子成直线型的,且相对分子质量最小的物质的结构式为________。
(3)M和T形成的化合物在潮湿的空气中冒白雾,反应的化学方程式为_________________。
(4)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为________。
(5)能源材料已成为当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_______(填序号)。
a. C60、Si60、N60都属于新型化合物
b. C60、Si60、N60互为同分异构体
c. 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com