
分析 (1)葡萄糖与氢氧化铜浊液反应生成葡萄糖酸和Cu2O,葡萄糖为还原剂,被氧化;
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4,铜为负极,被氧化,为正极,H2O2被还原;
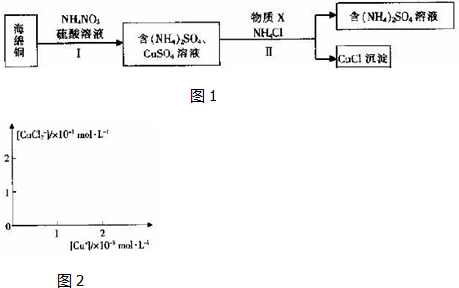
(3)海绵铜加入硫酸酸化的硝酸铵,由于酸性条件下硝酸根离子具有强氧化性,可氧化铜,加热温度不能太高,硝酸根离子可被还原生成氮氧化物,易导致环境污染,经步骤Ⅰ得到硫酸铵和硫酸铜溶液,经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,经过滤可得到CuCl和硫酸铵溶液,以此解答该题.
解答 解:(1)葡萄糖与氢氧化铜浊液反应生成葡萄糖酸和Cu2O,Cu元素化合价降低,被还原,为氢氧化铜为氧化剂,葡萄糖为还原剂,被氧化,故答案为:还原剂;
(2)正极上是元素化合价降低,得到电子发生还原反应,将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,是过氧化氢得到电子发生还原反应,其正极电极反应式是:H2O2+2H++2e-=2H2O,
故答案为:H2O2+2H++2e-=2H2O;
(3)海绵铜加入硫酸酸化的硝酸铵,由于酸性条件下硝酸根离子具有强氧化性,可氧化铜,因硝酸铵易分解,则加热温度不能太高,经步骤Ⅰ得到硫酸铵和硫酸铜溶液,经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,经过滤可得到CuCl和硫酸铵溶液,
①加热温度不能太高,硝酸根离子可被还原生成氮氧化物,易导致环境污染,故答案为:防止生成氮氧化物造成污染;
②0.5molNH4NO3参加反应有4mol电子转移,则N元素被还原为-3价,反应的离子方程式为4Cu+NO3-+10H+=4Cu2++NH4++3H2O,
故答案为:4Cu+NO3-+10H+=4Cu2++NH4++3H2O;
③经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,ad符合,故答案为:ad;
④步骤Ⅱ中物质X需要过量,除加快反应速率外,还起到防止CuCl被氧化的作用,故答案为:防止CuCl被氧化;
⑤已知:Ⅰ.CuCl(s)?Cu+(ap)+Cl-(ap) Ksp=1.4×10-6
Ⅱ.CuCl(s)+Cl-(ap)?CuCl2- (ap) K=0.35,
Ⅰ+Ⅱ可得2CuCl(s)?CuCl2- (ap)+Cu+(ap)K'=[Cu+][CuCl2-=1.4×10-6×0.35=0.49××10-6,即[Cu+][CuCl2-为常数,
则图象为 ,故答案为:
,故答案为: .
.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,题目考查较为全面,能较好的培养学生良好的科学素养,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比水的密度小 | |
| B. | 氨气极易溶于水 | |
| C. | SbH3的沸点比PH3高 | |
| D. | 溶解度:邻羟基苯甲醛<对羟基苯甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点-218℃,难溶于水 | |
| B. | 熔点3 900℃,硬度很大,不导电 | |
| C. | 难溶于水,固体时导电,升温时导电能力减弱 | |
| D. | 难溶于水,熔点高,固体不导电,熔化时导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子具有正四面体结构,两个碳氢键之间的夹角为109°28′ | |
| B. | 甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 | |
| C. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 | |
| D. | “抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳可做有机溶剂 | |
| B. | 可用工业酒精勾兑白酒 | |
| C. | 甲烷是清洁高效的燃料 | |
| D. | 用二氯甲烷只有一种结构证明甲烷空间结构是正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 温度(℃) | Na2CO3浓度(mol/L) | HCl浓度(mol/L) |
| A | 0 | 0.1 | 0.1 |
| B | 20 | 0.1 | 0.1 |
| C | 40 | 0.1 | 0.2 |
| D | 40 | 0.2 | 0.2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com