
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2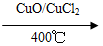 2Cl2+2H2O
2Cl2+2H2O
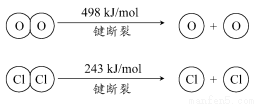
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
ⅱ.
①H2O的电子式是________。
②反应A的热化学方程式是______________________________________。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
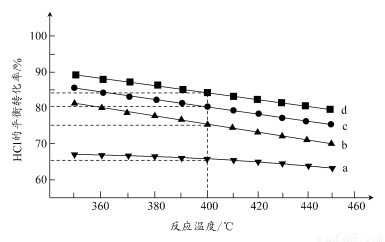
①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是________。

②4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
ΔH=-115.6 kJ/ mol
③32 强
(2)①4:1
②投料比越高,对应的反应温度越低
③30.8%
【解析】(1)③设H—O键的键能为x,H—Cl键的键能为y,则有-115.6=-2×243-4x+4y+498,化简得x-y=31.9,即断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ,H2O中H—O键比HCl中H—Cl键强。
(2)①同一温度下,O2的浓度越大,HCl的平衡转化率越高,故曲线a、d分别对应n(HCl):n(O2)为6:1、1:1的情况,曲线b对应的投料比是4:1。
②在图上作一平行于温度轴的直线与曲线b、c、d相交,可以看出,当不同投料比下HCl的平衡转化率相同时,曲线b对应的温度最低,曲线d对应的温度最高。则可得出结论:投料比越高,对应的反应温度越低。
③此时HCl的平衡转化率为80%。设反应开始时n(HCl)=2a mol,n(O2)=a mol。
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
起始 2a mol a mol 0 0
转化 1.6a mol 0.4a mol 0.8a mol 0.8a mol
平衡 0.4a mol 0.6a mol 0.8a mol 0.8a mol
则平衡混合气体中Cl2的物质的量分数是
 ×100%≈30.8%。
×100%≈30.8%。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
| A | B | C |
Ⅰ | 0.050 mol·L-1 | 0.050 mol·L-1 | 0.050 mol·L-1 |
Ⅱ | 0.070 mol·L-1 | 0.070 mol·L-1 | 0.098 mol·L-1 |
Ⅲ | 0.060 mol·L-1 | 0.060 mol·L-1 | 0.040 mol·L-1 |
Ⅳ | 0.080 mol·L-1 | 0.080 mol·L-1 | 0.12 mol·L-1 |
针对上述系列试验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g)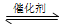 CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是( )
CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是( )
A.在一定条件下,使用催化剂能加快反应速率
B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
某可逆反应过程能量变化如图所示,下列说法中正确的是( )
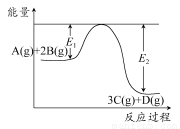
A.该反应热化学方程式为A(g)+2B(g)  3C(g)+D(g) ΔH>0
3C(g)+D(g) ΔH>0
B.其他条件不变,升高温度,A的转化率增大
C.其他条件不变,增大压强,释放热量减少,平衡常数K减小
D.其他条件不变,加催化剂,反应速率增大,E1和E2均减小,ΔH不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2 Li+2SO2 Li2S2O4。下列说法正确的是( )
Li2S2O4。下列说法正确的是( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e-=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
下列说法不正确的是( )
A.粗铜电解精炼时,应将粗铜与直流电源的正极相连
B.金属的吸氧腐蚀的过程中,正极的电极反应式为O2+2H2O+4e-=4OH-
C.燃料电池中加入燃料的电极一定是电池的负极
D.在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
短周期元素A、B、C的原子序数依次增大。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是( )
A.原子半径:A<B<C
B.A单质的氧化性小于C单质
C.B的硫酸盐溶液pH<7
D.B元素单质可溶于酸但不溶于碱
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:选择题
下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤Cu与HNO3溶液反应,由于HNO3的浓度不同可发生不同的氧化还原反应
A.都正确 B.②③④⑤ C.②③⑤ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com