
| A. | $\frac{2b-c}{a}$ | B. | $\frac{2b-c}{2a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6}$ |
分析 根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O计算NH4+的物质的量,再根据c=$\frac{n}{V}$计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
解答 解:将Al2(SO4)3和(NH4)2SO4的混合溶液2a L分为两等份,每份的体积为a,
向aL混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
bmol bmol
c(SO42-)=$\frac{bmol}{aL}$=$\frac{b}{a}$mol/L,
向aL混合溶液中加入足量强碱并加热可得到cmolNH3,则:
NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
cmol cmol
c(NH4+)=$\frac{cmol}{aL}$=$\frac{c}{a}$mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+$\frac{c}{a}$mol/L×1=$\frac{b}{a}$mol/L×2,
解得x=$\frac{2b-c}{3a}$mol/L,
故选C.
点评 本题考查混合物的有关计算、物质的量浓度的计算等,题目难度中等,明确发生的离子反应及溶液不显电性是解答本题的关键,注意熟悉物质的量浓度的计算公式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
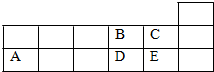
| A. | 它们的简单离子半径大小关系为:A>D>E>B>C | |
| B. | 氧化物的水化物的酸性强弱关系:E>D>A | |
| C. | 化合物E2B的分子中B原子的杂化方式为sp3 | |
| D. | 工业上将E单质通入澄清石灰水中反应制漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量为2mol的BaCl2中,含有Cl-个数为2NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
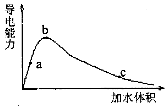 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的PH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的PH试纸上,测得PH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 己知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则水电离的热化学方程式为:H2O(l)?H+ (aq)+OH-(aq)△H=+57.3 kJ•mol-1 | |
| D. | 向0.1mol/L的CH3COONa溶液中加入少量醋酸钠固体,c(CH3COO-)/c(Na+ )变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯蔗糖(C12H19Cl3O8)属于天然的糖类甜味剂 | |
| B. | 未成熟的青苹果肉遇碘酒变蓝色,成熟苹果的汁能发生银镜反应 | |
| C. | 利用盐析的方法可以用来分离、提纯蛋白质 | |
| D. | 酚醛树脂、合成橡胶、有机玻璃都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
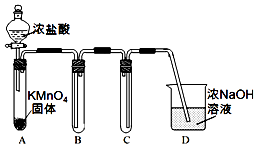 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | V1mL | V2mL | V3mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | V4mL | 3mL | 0mL |
| 硫酸(6mol/L) | V5mL | 2mL | V6mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com