
| 药品柜编号 | ① | ② | ③ | ④ | … |
| 药品 | 氢氧化钠 氢氧化钙 | 盐酸 硫酸 | 二氧化锰 氧化铜 | 氯化钠 硫酸钠 | … |
| A. | ③和① | B. | ④和① | C. | ①和② | D. | ③和④ |
分析 根据生石灰和纯碱的组成和性质可知,生石灰是由钙和氧组成的化合物,属于氧化物;纯碱是由纳离子和碳酸酸根离子组成的化合物,属于盐,同类别的物质应放在一个柜子里.
解答 解:生石灰是由钙和氧组成的化合物,属于氧化物;纯碱是由纳离子和碳酸酸根离子组成的化合物,属于盐,同类别的物质应放在一个柜子里.
①氢氧化纳和氢氧化钙电离时生成的阴离子都是氢氧根离子,都属于碱;
②盐酸和硫酸电离时生成的阳离子都是氢离子,都属于酸;
③二氧化锰和氧化铜都是由两种元素组成,且其中一种是氧的化合物,都属于氧化物;
④氯化钠和硫酸钠都是由金属离子和酸根离子组成的化合物,都属于盐;所以该实验室新购进部分生石灰和纯碱应将它们分别放在③和④,
故选D.
点评 本题考查学生对物质类别的认识和药品的存放,学生应明确分类是一种科学的方法,要在平时的学习中多应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
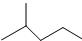 表示的分子式C6H14;名称是2-甲基戊烷,核磁共振氢谱中有5组峰.
表示的分子式C6H14;名称是2-甲基戊烷,核磁共振氢谱中有5组峰.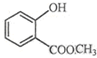 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32- | |
| B. | NaCl溶液与Na2CO3固体灼烧时火焰颜色相同 | |
| C. | 通过灼热的CuO,能使固体由黑变红的气体一定是H2 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打断$\frac{a}{3}$mol的N-H键同时消耗$\frac{a}{6}$mol的尿素 | |
| B. | 密闭容器中混合气体的平均摩尔质量保持不变 | |
| C. | 密闭容器中混合气体的密度保持不变 | |
| D. | 密闭容器中二氧化碳的体积分数保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
| B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 名称 | 食醋 | 白酒 | 白糖水 | 石灰水 | 纯碱溶液 |
| 主要成分 | CH3COOH | C2H5OH | C12H22O11 | Ca(OH)2 | Na2CO3 |
| 溶液PH | 3 | 7 | 7 | 11 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com