
| A.c(NO3-)= 1mol.L-1的溶液中:NH4+、Ba2+、Fe2+ 、Br- |
| B.水电离出c(OH-)= 10-10mol.L-1的溶液: HCO3-、K+、Na+、Cl- |
| C.在pH=2的溶液中:NH4+、K+、ClO-、Cl- |
| D.c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
科目:高中化学 来源:不详 题型:单选题
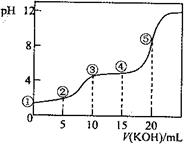
| A.点①所示溶液中: c(H+)/c(OH—)=1012 |
| B.点②所示溶液中: c(K+)+c(H+)=c(HC2O4—)+c(C2O42-)+c(OH—) |
| C.点③所示溶液中:c(K+)>c(HC2O4—)> c(H2C2O4)>c(C2O42-) |
| D.点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4—) +c(C2O42-)=0.10mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
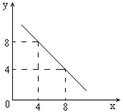
| A.Cu2+ | B.Na+ | C.Fe2+ | D.Ag+ |
 Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3COO-、 Cl-、K+、 H+ | B.SO42-、Cl-、Ba2+、Na+ |
| C.Cl-、NO3-、NH4+、Na+ | D.HCO3-、NO3-、Al3+、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.40mL | B.60mL | C.80mL | D.120 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+,Cl—,CO32-,Na+ | B.H+,Ba2+,Fe 3+,S2- |
| C.NH4+,SO42-,K+,OH- | D.H +,NO3-,Na+,SiO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba2+、Cu2+、NO3―、SO42― | B.CO32―、H+、Na+、K+ |
| C.K+、Na+、SO42―、Cl― | D.H+、Cl―、NO3―、Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ω=17c/(1000ρ) | B.c=1000Vρ/(17V+22400) |
| C.ω=17V/(17V+22400) | D.ρ=(17V+22400)/(22.4+22.4V) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com