
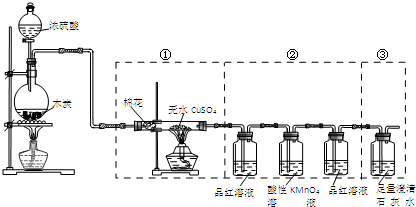
| A、实验时可观察到装置①中白色硫酸铜粉末变蓝色 | B、装置②中两次用到品红溶液的作用相同 | C、装置③用于检验产物中二氧化碳气体的生成 | D、如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
| ||
| ||


科目:高中化学 来源: 题型:阅读理解

| 仪器 | 加入试剂 | 预期实验现象 |
| A | 绿矾试样 | 残留红棕色固体 残留红棕色固体 |
| B | 无水硫酸铜 无水硫酸铜 |
白色粉末变蓝 白色粉末变蓝 |
| D | 品红或酸性高锰酸钾溶液或溴水 品红或酸性高锰酸钾溶液或溴水 |
溶液褪色 溶液褪色 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
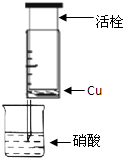 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
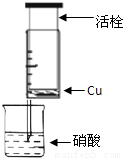
科目:高中化学 来源:2011-2012学年浙江省杭州市七校联考高一(下)期中化学试卷(解析版) 题型:填空题
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com