
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
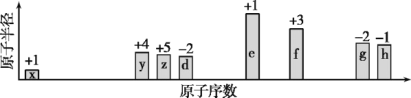
根据判断出的元素回答问题:
(1)h在周期表中的位置是_______。
(2)比较d、f离子半径大小(用化学式表示,下同):_>_。g、h的最高价氧化物对应水化物的酸性强弱:__ >__。
(3)h的单质与e的最高价氧化物对应水化物反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如下图所示:
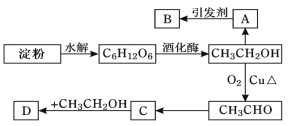
其中:A是乙烯,能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”的名称是________,A的电子式为________,C中含有官能团名称_______。
(2) A→B反应类型______________。
(3)写出下列转化的化学方程式
C→D:_____________________,
CH3CH2OH→CH3CHO:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10. 4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为____________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛-铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的外围电子排布式为_____。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要________(填“高”、“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯二甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有_______个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为__________。
③H、C、N、O四元素,其电负性从大到小的顺序依次为___________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与![]() 空间构型相同的一种阳离子:________(填离子符号)。
空间构型相同的一种阳离子:________(填离子符号)。
(4)已知单质钒的晶胞如上图5所示,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为__________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色环保,人人有责。下列行为或方法不符合环保要求的是( )
A.大力发展小型火力发电厂B.进行垃圾分类并进行无害化处理
C.使用无毒、可降解的食品包装材料D.改进生产工艺和设备,减少“三废”排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为( )
A.0.15mol/LB.0.20 mol/LC.0.35 mol/LD.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的正确说法是( )
A.聚乙烯可发生加成反应
B.石油干馏可得到汽油、煤油等
C.淀粉、蛋白质完全水解的产物互为同分异构体
D.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com