
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
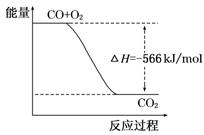
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO2(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
C
【解析】燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,燃烧热的单位是kJ/mol,所以选项A不正确;选项B不正确,应该表示的是2molCO和1mol氧气生成2molCO2的反应过程和能量关系;应用气态CO2的能量高于固态CO2的能量,所以过氧化钠和固态CO2反应放出的热量少,则△H就大于452kJ/mol,选项C正确;根据盖斯定律可知,(①+②×2)÷2即得到Na2O2(s)+CO(g)===Na2CO3(s),所以该反应的反应热是△H=(-566 kJ/mol-226 kJ/mol×2)÷2=-509kJ/mol。此时反应中转移电子的物质的量是2mol,选项D不正确,答案选C。


科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
![]() Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
![]() 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是

![]() A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
![]() B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系
![]() C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
![]() D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol

![]() Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
![]() 根据以上热化学方程式判断,下列说法正确的是( )
根据以上热化学方程式判断,下列说法正确的是( )
![]() A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
![]() B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系
![]() C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
![]() D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2010年安丘中学高二暑期练习化学卷(一) 题型:选择题
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol; Na2O2(s)+CO(g)=Na2CO3(s) ΔH=-226 kJ/mol 根据以上热化学方程式判断,下列说法正确的是

A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO(s)=2Na2CO3(s) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为 6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com