
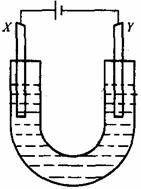
下图是用石墨和铁作电极电解饱和食盐水的装置。请填空:
(1)X的电极名称是_________极,发生的电极反应式为 ____,Y极的电极材料是__________,检验X极的产物方法是_______。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收到预期产物。一段时间后又将两极的连接方式纠正过来,发现X一端出现了白色沉淀,此沉淀是___________(填化学式)。其形成原因是__________________,该沉淀在空气中放置,现象是______________________。
科目:高中化学 来源: 题型:阅读理解
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 高温 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:022
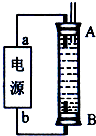
由于Fe(OH)2,极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用下图电解实验可以制得白色纯净的Fe(OH)2沉淀,两电极材料分别为石墨和铁。
(1)a电极材料应为________,电极反应式为________。
(2)电解液c可以是________(填编号)。
( )
A. 纯水
B. NaCl溶液
C. NaOH溶液
D. CuCl2溶液
(3)d为苯,其作用是________,在加入苯之前对c应作何简单处理________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)________。
( )
A. 改用稀硫酸作电解液
B. 适当增大电源的电压
C. 适当减小两电极间距离
D. 适当降低电解液的温度
(5)若c中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电 源电解,除了电极上看到气泡外,混合物中另一明显现象为________。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022

(1)a电极材料应为________,电极反应式为________。
(2)电解液c可以是________(填编号)。
( )
A. 纯水
B. NaCl溶液
C. NaOH溶液
D. CuCl2溶液
(3)d为苯,其作用是________,在加入苯之前对c应作何简单处理________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)________。
( )
A. 改用稀硫酸作电解液
B. 适当增大电源的电压
C. 适当减小两电极间距离
D. 适当降低电解液的温度
(5)若c中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电 源电解,除了电极上看到气泡外,混合物中另一明显现象为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省资阳市4月高考模拟考试理综化学试卷(解析版) 题型:填空题
工业上常用铬铁矿(有效成份为FeO·Cr2O3,主要杂质为SiO2、Al2O3)为原料生产重铬酸钾(K2Cr2O7),实验室模拟工业法用铬铁矿制重铬酸钾的主要工艺流程如下图,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O,试回答下列问题:

(1)⑤中溶液金属阳离子的检验方法是 。
(2)步骤③被沉淀的离子为(填离子符号) 。
(3)在反应器①中,二氧化硅与纯碱反应的化学方程式为: 。
(4)烟道气中的CO2可与H2合成甲醇。CH3OH、H2的燃烧热分别为:ΔH=-725.5 kJ/mol、ΔH=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
(5)2011年云南曲靖的铬污染事件,说明含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
①写出电解法处理废水的总反应的离子方程式 。
②已知Cr(OH)3的Ksp=6.3×10–31,若地表水铬含量最高限值是0.1 mg/L,要使溶液中c(Cr3+)降到符合地表水限值,须调节溶液的c(OH-)≥ mol/L(只写计算表达式)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省岳阳市高三第一次质量检测化学试卷(解析版) 题型:填空题
(6分)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1) 甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= —1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2= —566 kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
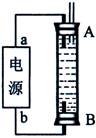
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)===CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com