
| A. | 7.5% | B. | 大于7.5%. | C. | 小于7.5% | D. | 无法确定 |
分析 加水稀释时稀释前后溶液中溶质的质量不变,该氨水用等体积的水稀释后,所得氨水的质量为原氨水质量与所加水质量和,所得氨水溶液中溶质为15%的氨水中溶质,利用溶液的溶质质量分数计算式求出所得氨水的质量分数;其中需要使用m=ρV对体积进行换算.
解答 解:设加水的体积为V,则15%的氨水体积也为V,设氨水密度为ρg/cm3(ρ<1),水的密度为1g/cm3,
该氨水用等体积的水稀释后,所得氨水的质量分数=$\frac{V×ρg/c{m}^{3}×15%}{V×ρg/c{m}^{3}+V×1g/c{m}^{3}}$×100%=$\frac{ρ}{ρ+1}$×15%<7.5%;
故选C.
点评 本题考查了有关溶质质量分数的简单计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意密度对溶液体积和质量分数的影响.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:选择题
 T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2 mol/(L•min) | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应放热反应 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 曲线Ⅱ对应的条件改变是加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
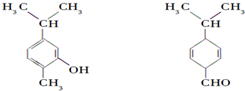
| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 均能与H2在一定条件下发生加成反应 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
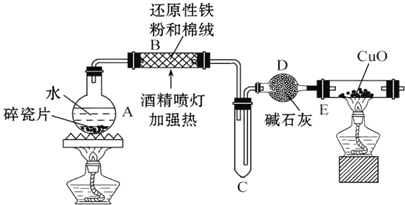 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
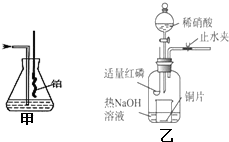 Ⅰ、实验室模拟氨催化氧化的装置如图甲:
Ⅰ、实验室模拟氨催化氧化的装置如图甲:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
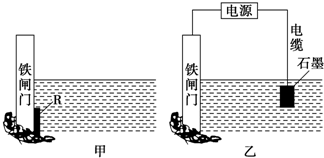 下面两个图都是金属防护的例子.
下面两个图都是金属防护的例子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
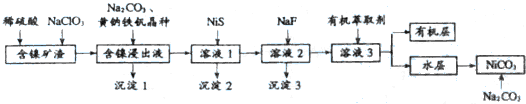
| 元素 | Na2+ | Fe3+ | Cu2+ | Ca2+ | Mg2+ | Zn2- |
| 浓度/g•L-1 | 5.25 | 0.47 | 0.30 | 0.40 | 0.18 | 0.81 |
| 开始沉淀PH | 6.4 | 2.2 | 4.7 | / | 9.6 | 6.5 |
| 完全沉淀PH | 8.4 | 3.5 | 6.7 | / | 11.6 | 8.5 |
| 难溶物 | NiS | CuS | ZnS | |
| 溶度积常数 | 1.07×10-21 | 1.27×10-26 | 2.93×10-25 | |
| 难溶物 | CaF2 | MgF2 | ZnF2 | NiF2 |
| 溶度积常数 | 1.46×10-10 | 7.42×10-11 | 3.04×10-2 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com