
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8 kJ/mol。
己知:2 Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ/mol,则O3转化为O2的热化学方程式为 ;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。
|
时间/min浓度(mol/L) |
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0·30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.l7 |
(2)用活性炭还原法处理氮氧化物,有关反应为: C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10 min~20 min以内v(CO2)表示的反应速率为
②根据表中数据,计算T1℃时该反应的平衡常数K= (保留两位小数);
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
(1)①2O3(g)=3O2(g) △H=-285kJ/mol (2分) ②2H++O2+2e-=H2O2(2分)
(2)①0.009mol/(L•min)(没写单位不给分,2分)
②0.56(2分)③C、D(2分)④减小CO2的浓度(2分)⑤不变(2分)
【解析】
试题分析:(1)①a、6Ag(s)+O3(g)=3Ag2O(s) △H=-235.8 kJ/mol,b、2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ/mol,所以依据盖斯定律可知,a×2+b×3即得到:2O3(g)=3O2(g),所以该反应的反应热△H=-235.8 kJ/mol ×+62.2kJ/mol ×3=-285kJ/mol;即2O3(g)=3O2(g) △H=-285kJ/mol。
②电解池中阳极失去电子,发生氧化反应。阴极得到电子,发生还原反应。根据阳极制得臭氧,阴极制得过氧化氢可知,电解的总反应方程式为3H2O+3O2 3H2O2+O3,其中阳极反应为3H2O-6e-=O3+6H+,阴极反应为6H++3O2+6e-=3H2O2。
3H2O2+O3,其中阳极反应为3H2O-6e-=O3+6H+,阴极反应为6H++3O2+6e-=3H2O2。
(2)①根据表中数据可知10 min~20 min以内v(CO2)表示的反应速率=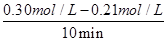 =0.009mol/(L•min)。
=0.009mol/(L•min)。
②根据表中数据可知T1℃时该反应平衡浓度为,c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,所以该温度下该反应的平衡常数K=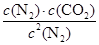 =
=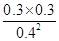 =0.56。
=0.56。
③根据反应式C(s)+2NO(g) N2(g)+CO2(g)可知,反应是气体体积不变的反应。在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,则A、反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故A错误;B、反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,v正(NO)=2v正(N2)只能说明反应正向进行,故B错误;C、容器内CO2的体积分数不变,说明反应达到平衡,故C正确;D、混合气体密度等于气体的总质量除以容器的体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故D正确,答案选CD。④30min时改变某一条件,反应重新达到平衡,根据表中数据可知c(N2)=0.34mol/L、c(CO2)=0.17mol/L、c(NO)=0.32mol/L,所以依据平衡常数K=
N2(g)+CO2(g)可知,反应是气体体积不变的反应。在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,则A、反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故A错误;B、反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,v正(NO)=2v正(N2)只能说明反应正向进行,故B错误;C、容器内CO2的体积分数不变,说明反应达到平衡,故C正确;D、混合气体密度等于气体的总质量除以容器的体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故D正确,答案选CD。④30min时改变某一条件,反应重新达到平衡,根据表中数据可知c(N2)=0.34mol/L、c(CO2)=0.17mol/L、c(NO)=0.32mol/L,所以依据平衡常数K=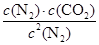 可知,K=
可知,K=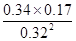 =0.56,即平衡常数不变。由于化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以可能是减小容器体积后加入氮气。
=0.56,即平衡常数不变。由于化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以可能是减小容器体积后加入氮气。
⑤一定温度下,随着NO的起始浓度增大,反应C(s)+2NO(g)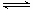 N2(g)+CO2(g)是气体体积不变的反应;增大一氧化氮浓度相当于增大体系压强,平衡不动,一氧化氮转化率不变。
N2(g)+CO2(g)是气体体积不变的反应;增大一氧化氮浓度相当于增大体系压强,平衡不动,一氧化氮转化率不变。
考点:考查盖斯定律进行有关反应热的计算;化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算;电解原理的应用等


科目:高中化学 来源: 题型:阅读理解
| pH | 3.0 | 4.0 | 5.0 | 6.0 |
| t/min | ||||
| T/℃ | ||||
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| 0.012ac |
| V |
| 0.012ac |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0?30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com