
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2011-2012学年天津市塘沽区塘沽一中、汉沽一中、大港一中联考高二(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省威海市荣成市成山头实验中学高二(上)期中化学试卷(解析版) 题型:填空题
 )+c一定等于
)+c一定等于 查看答案和解析>>
科目:高中化学 来源:2013年山东省德州市高考化学一模试卷(解析版) 题型:解答题
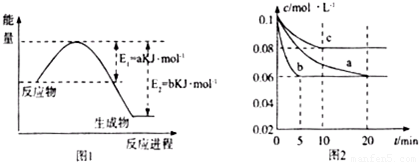
| T/(K) | 298 | 398 | 498 | … |
| K/-2 | 4.1×106 | K1 | K2 | … |
 ]>[NH
]>[NH ]>[H+]>[OH-]
]>[H+]>[OH-] ]>[SO
]>[SO ]>[OH-]>[H+]
]>[OH-]>[H+] ]+[H+]>[SO
]+[H+]>[SO ]+[OH-]
]+[OH-]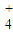 ]>[SO
]>[SO ]>[H+]>[OH-].
]>[H+]>[OH-].查看答案和解析>>
科目:高中化学 来源:2013年安徽省淮南市高考化学一模试卷(解析版) 题型:解答题
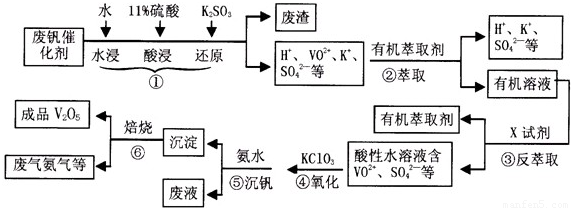
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com