
| ||
| ||
| 200g×(m-n)g |
| 62g |
| 100(m-n) |
| 31 |
| 100(m-n) |
| 31 |
| 100(m-n) |
| 31 |
| 100(m-n) |
| 31 |
| ||
| mg×138g |
| 200g |
| 69m |
| 100 |
| 69m |
| 100 |
| 69m |
| 100 |
| ng |
| 138g/mol |
| n |
| 69 |
| n |
| 69 |
| 149n |
| 138 |
| 149n |
| 138 |


科目:高中化学 来源: 题型:
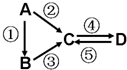 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 操 作 | 答案 | 实 验 现 象 |
| (1)让一束光通过Fe(OH)3胶体 | A.棕色烟 B.生成白色胶状沉淀 C.呈现光亮的“通路” D.呈黄色 | |
| (2)向盛有AlCl3溶液的试管中加入氨水 | ||
| (3)用铂丝蘸取碳酸钠溶液,在无色火焰上灼烧,观察火焰 | ||
| (4)把红热铁丝插入盛Cl2的集气瓶中,铁丝燃烧并产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
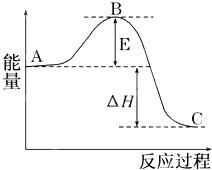 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
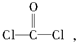 每个COCl2分子内含有
每个COCl2分子内含有查看答案和解析>>
科目:高中化学 来源: 题型:
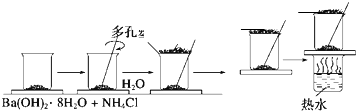 在研究化学反应中的能量变化时,我们通常做下面的实验:在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2?8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.
在研究化学反应中的能量变化时,我们通常做下面的实验:在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2?8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的红色石蕊试纸变蓝的气体产生,此气体为 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主食 | 米饭 |
| 副食 | 红烧鱼 |
| 饮品: | 豆浆 |
| 你的补充 | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com