
| 1.0×10-12 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
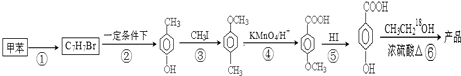
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
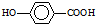
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 的同分异构体很多,其中符合下列条件有
的同分异构体很多,其中符合下列条件有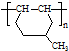 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
查看答案和解析>>
科目:高中化学 来源: 题型:
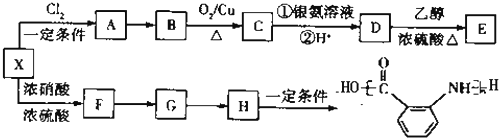
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6与氯气发生取代反应、C2H4与HCl发生加成反应均可得到纯净的C2H5Cl |
| B、将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 |
| C、乙烯结构中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应 |
| D、苯使酸性KMn04溶液、溴水都褪色,发生的都是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
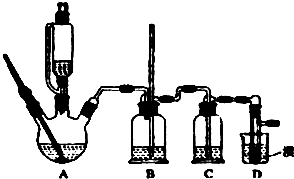 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH| H2SO4(浓) |
| 170℃ |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol?L-1 |
| ① | 常温 | 粗颗粒 | 2.00 |
| ② | 常温 | 1.00 | |
| ③ | 粗颗粒 | 2.00 | |
| ④ | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| H2 |
| Ni,△ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
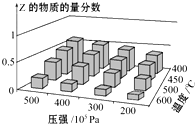 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com