
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
【答案】A
【解析】
草酸属于二元弱酸,滴加NaOH溶液,发生H2C2O4+NaOH=NaHC2O4+H2O,NaHC2O4+NaOH=Na2C2O4+H2O,然后进行分析;
草酸属于二元弱酸,滴加NaOH溶液,发生H2C2O4+NaOH=NaHC2O4+H2O,NaHC2O4+NaOH=Na2C2O4+H2O,
A、根据图像,H2C2O4二级电离常数表达式K=c(C2O42-)×c(H+)/c(HC2O4-),在pH=4.3时,c(C2O42-)=c(HC2O4-),此时H2C2O4的二级电离常数为10-4.3,不是H2C2O4的一级电离常数,故A说法错误;
B、根据图像,pH=2.7的溶液中,c(H2C2O4)=c(C2O42-),故B说法正确;
C、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),当pH=7时,c(H+)=c(OH-),有c(Na+)=c(HC2O4-)+2c(C2O42-),因此c(Na+)>2c(C2O42-),故C说法正确;
D、溶液为电中性,滴加氢氧化钠溶液过程中始终存在c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故D说法正确;


科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)烷烃A在同温同压下蒸气的密度是氢气的36倍,A的分子式:_______。
(2)烷烃B的分子中含有200个氢原子,烷烃B的分子式:________。
(3)请用化学方程式表示氯碱工业的反应原理:________。
(4)请用化学方程式表示铝热法炼铁的反应原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是降低润滑油凝固点的高分子有机化合物,其结构简式为 ,用石油裂解气合成M的路线如下
,用石油裂解气合成M的路线如下
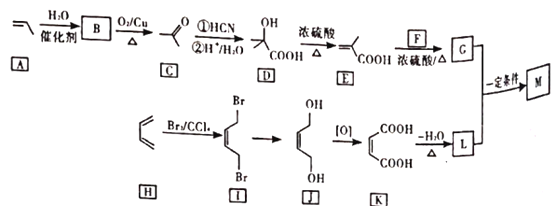
回答下列问题:
(1)B的化学名称为___________。
(2)F的分子式为___________。
(3)G中官能团的名称是___________,G与L在一定条件下生成M的反应类型是___________。
(4)I→J的反应方程式为___________。
(5)写出C的同分异构体的结构简式(核磁共振氢谱为三组峰,峰面积比为3︰2︰1)______。
(6)设计由苯乙烯为起始原料制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
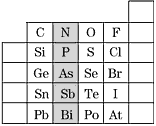
(1)上图中元素N在元素周期表中的位置为_________________,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________;判断表中Bi和Te两种元素的金属性强弱:Bi________Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(5)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素是一种重要的氮肥,它的合成主要发生以下2步反应:
反应1:2NH3(g)+CO2(g) ![]() NH4COONH2(1) △H1=a kJ·mol-1
NH4COONH2(1) △H1=a kJ·mol-1
反应2:NH4COONH2(1)=====NH2CONH2(1)+H2O(1) △H2=b kJ·mol-1
回答下列问题:
(1)写出合成尿素的热化学方程式:_____________________(用含a、b的代数式表示)。写出一种可以提高NH3平衡转化率的措施:_______________________________。
(2)95℃时,在2L恒容密闭容器中加入3mol氨气和1molCO2使之充分反应合成尿素,达到平衡时,CO2的转化率为60%,则此温度下合成尿素的平衡常数是________________(保留2位小数)。
(3)下表为反应1和反应2在不同温度下达到平衡时所测得的平衡常数(K)的数据。

①从上表数据可推出b_____(填“>”或“<”)0,理由是______________________。
②升高温度,反应1的反应速率将_________(填“增大”或“减小”)。
③下图是合成尿素时温度对二氧化碳转化率的影响曲线。从图中可知A、B、C三点对应的温度下该反应的平衡常数大小关系是_________________(用KA、KB、KC表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是
①化学键只存在于分子之间
②化学键是相邻原子之间强烈的相互作用
③化学键是一种静电作用
④化学键是相邻分子之间强烈的相互吸引
⑤离子化合物中可能含有共价键
⑥共价化合物中可能含有离子键
⑦离子化合物中只含离子键
⑧共价化合物中不含离子键
A.②③④⑦B.②③⑤⑧
C.②④⑤⑥D.①③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有35.8g Na2CO3和NaHCO3混合物的溶液中加入200mL 某浓度的盐酸,恰好完全反应,生成8.96L CO2(标准状况)。问:
(1)原溶液中有__________mol Na2CO3,__________mol NaHCO3。
(2)盐酸的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com