
�ס��ҡ����������������ͼ��ʾ�Ľṹ��ṹ��Ԫ��ͼ��������������еIJ���δ������ֻ��ʵ�߱�ʾ���ۼ���X��Y��ͬ�ɲ�ͬ��
��֪���ס��Ҿ���������ͬ�����ʼ������ҷ����û���Ӧ�������������������Ӿ����е������ܵ����������б�������ͬһ�ྦྷ���еķ��ӣ����ڳ����³�Һ̬���ܲ�������10���ӵ����ӣ�������������������ϡ��ȵ���ԭ������������ͬ��������ԭ�����ķ��ӻ����ӻ���Ϊ�ȵ����壩����ͨ��Ϊ��������ṹ���ƣ��������ж���24���۵��ӡ�
��1��д��Һ̬���������ֵȵ������ӵĵ��뷽��ʽ�� ��
��2��X��Yԭ�ӵ�����㶼����8���ӵķ����� ������ĸ���ţ�
A���� B���� C���� D���� E����
��3��д�������ҷ����û���Ӧ�ķ�Ӧ����ʽ�� ��
��4������Ŀǰ��Ҫ����Դ֮һ��
�� ���ͼ��ڴ������������µõ���ȼ�Ե��������壬�䷴Ӧ�Ļ�ѧ����ʽ�ǣ� ��
�� �ִ����ܵ���У����ñ���ȼ�ϵ�ص�ԭ�ϣ��ڼ��Խ���(KOH��Һ)������£���������Ӧ�ĵ缫����ʽΪ ��
��5����д��һ��������ϡ��ȵ���ԭ���������� ��
��A ��B ��C ��D ��E ���ֶ�����Ԫ�أ�ԭ������������������ͬ���壬A ��B ��C �ֱɵ�������ȵĻ�����w��k����w��һ���ܲ�������ЧӦ�����壻D Ԫ�������������Ǵ�����������3 ����A ��B ��C ��D ���γɻ�����x��A ��D ��E ���γɻ�����y��A ��C ��D ���γɻ�����z��x��y��z ��Ϊ�����Ӻ������Ӹ�������1 : 1 �����ӻ�����ش��������⣺
��1��y�ĵ���ʽΪ_________________��w����______ (����ԡ��Ǽ��ԣ����ӣ�
��2����E ͬ������Ϊ�������ڵ�Ԫ��ԭ������Ϊ_________________��
��3����ͬ�����⻯������ʵݱ��У�k �ķе㷴�����������__________�����ͣ�����ĸ��ţ���
A�����۽� B�����Ӽ�������C�����������D�������߶�˹��
��4�������£�x ��y�����ʵ���֮��1 : 2 ��Ӧ��������Һ��_______����ᡱ��������С����ԣ��ɲ��������ԭ����________________________�������ӷ���ʽ��ʾ����
��5����k��D �ĵ��ʡ�KOH ��Һ����ԭ��أ����������C �ĵ��ʡ����为����ӦΪ______________________________��һ��ʱ�����ҺpH__________�����������С�����䡱 ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
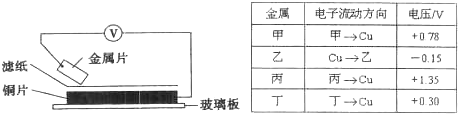
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�





 HCO3-+OH-��ʹ��Һ�ʼ���
HCO3-+OH-��ʹ��Һ�ʼ��� HCO3-+OH-��ʹ��Һ�ʼ���
HCO3-+OH-��ʹ��Һ�ʼ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

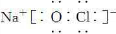
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com