


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名 称 | 结构简式 | 名 称 | 结构简式 |
| 2-甲基丁烷 | 2-丙醇 | ||
| C(CH3)4 | 甘油 | ||
| 异戊烷 | 甲醛 | ||
| 2-丁炔 | 丙酮 | ||
| 间二甲苯 | 甲酸甲酯 | ||
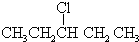 | 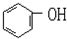 | ||
| CH2BrCH2Br | -CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)在温度为298K时能自发进行,则它的△H>0,△S>0 |
| B、0.1mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断减小 |
| C、为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 |
| D、反应:2A(g)?B(g)+2C(g),增大压强反应速率加快,A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、c(OH-)>c(H+)>c(B+)>c(A-) |
| B、c(H+)<c(OH-)<c(A-)<c(B+) |
| C、c(OH-)<c(H+)<c(B+)<c(A-) |
| D、c(B+)=c(A-)<c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子数为6 |
| B、最高价氧化物的水化物的分子式为 H2SeO4 |
| C、Br的非金属性比Se强 |
| D、气态氢化物的还原性比硫化氢气体弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com