
| A、a% | ||
| B、1-1.75 a% | ||
C、
| ||
D、
|
| 32 |
| 32+24 |
| 4 |
| 7 |


科目:高中化学 来源: 题型:
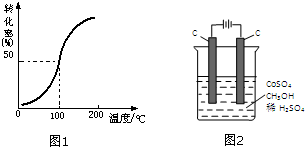 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 且a、b、c、d均大于零,则下列说法正确的是( )
且a、b、c、d均大于零,则下列说法正确的是( )| A、断开1molH-Cl键所需的能量为-a-b-c |
| B、b>c,则氢气分子具有的能量高于氯气分子具有的能量 |
| C、Cl2(s)=Cl2(g)△H=+(a+d)kJ?mol-1 |
| D、向1molCl2(g)中通入1molH2(g),发生反应时放热dkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
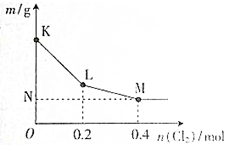 向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )
向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )| A、K→L段发生反应的离子方程式为2Br-+Cl2═2Cl-+Br2 |
| B、原溶液中,c(Na+ )=4mol?L-1 |
| C、原溶液中,c(I-)=2mol?L-1 |
| D、M点代表的固体质量为46.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝厂通过电解熔融氧化铝的方法冶炼铝 |
| B、制钠厂通过电解熔融氯化钠的方法生产金属钠 |
| C、用电解饱和食盐水的方法生产烧碱,同时得到氯气和氢气 |
| D、制钠厂通过电解饱和食盐水的方法生产金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
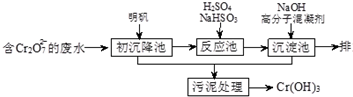
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝制器皿不宜盛放酸性食物 |
| B、电解食盐水时阴极产生氢气 |
| C、可用铁制容器盛放和运输浓硫酸 |
| D、镀锌铁桶镀层破损后铁仍不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阳极 |
| C、放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、充电时每生成1 mol CH3OH转移12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
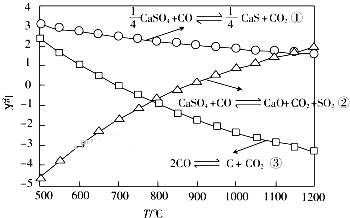 一氧化碳在高温下可还原硫酸钙,相关反应的平衡常数的对数与反应温度的关系如图所示.
一氧化碳在高温下可还原硫酸钙,相关反应的平衡常数的对数与反应温度的关系如图所示.| 1 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com