

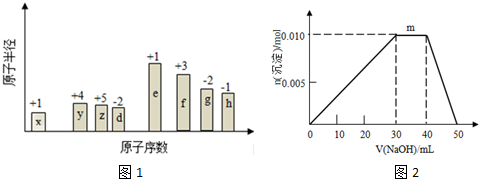
分析 贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以N是CaO,D是CO2,I为Ca(OH)2.海水暴晒得到固体B为NaCl,电解氯化钠反应得到氢气、氯气与NaOH,C、H为单质,则G为NaOH,且H能与I(氢氧化钙)反应生成J,则H为Cl2,C为H2,J为Ca(ClO)2、CaCl2混合物.空气分离得到单质B,B与金属Z反应生成Y的相对分子质量为100,则B为N2,Z为Mg,Y为Mg3N2,Y与水反应生成沉淀X为Mg(OH)2,则A为NH3.氯化钠、氨气和二氧化碳在溶液中反应生成碳酸氢钠和氯化铵,所以E是NH4Cl、F是NaHCO3,氯化铵与氢氧化钠反应可以生成氨气.
解答 解:贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以N是CaO,D是CO2,I为Ca(OH)2.海水暴晒得到固体B为NaCl,电解氯化钠反应得到氢气、氯气与NaOH,C、H为单质,则G为NaOH,且H能与I(氢氧化钙)反应生成J,则H为Cl2,C为H2,J为Ca(ClO)2、CaCl2混合物.空气分离得到单质B,B与金属Z反应生成Y的相对分子质量为100,则B为N2,Z为Mg,Y为Mg3N2,Y与水反应生成沉淀X为Mg(OH)2,则A为NH3.氯化钠、氨气和二氧化碳在溶液中反应生成碳酸氢钠和氯化铵,所以E是NH4Cl、F是NaHCO3,氯化铵与氢氧化钠反应可以生成氨气.
(1)反应①的化学方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)Z在空气中点燃可能发生多种反应,其中属于置换反应的是:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)实验室制取A物质的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)H与I的澄清溶液反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
(5)发生反应:CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,0.8mol CO2与1.0L 1mol•L-1的NaOH溶液恰好完全反应,NaOH物质的量为1mol,二氧化碳与氢氧化钠物质的之比为0.8:1=1:1.25,介于1:2~1:1之间,故反应生成NaHCO3、Na2CO3,设二者物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.8}\\{x+2y=1}\end{array}\right.$,解得x=0.6,y=0.2,
故答案为:NaHCO3为0.6mol、Na2CO3为0.2mol.
点评 本题考查无机物推断,涉及联氨制碱法、氯碱工业等,熟练掌握元素化合物知识,掌握中学常见化学工业.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当V=10时,c(Na+)>c(OH-)>c(HC0${\;}_{3}^{-}$)>c(CH3COO-)>c(H+) | |
| B. | 当 0<V<20 时,c(H+)+c(Na+)=c(HC0${\;}_{3}^{-}$)+c(CH3COO-)+2 c(C032-)+c(OH-) | |
| C. | 当 V=20 时,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 当 V=40 时,c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
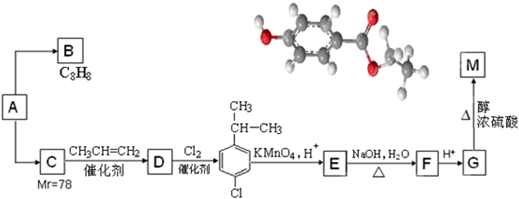
 .
.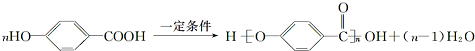 .
.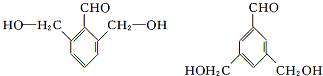 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室制取乙烯 | B. |  利用酒精萃取碘水中的I2单质 | ||
| C. |  实验室制取乙炔并收集 | D. |  石油的分馏实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com