
【题目】某物质熔融状态可导电,固态可导电,将其投入水中,水溶液也可导电,则可推测该物质可能是
A. 金属 B. 非金属 C. 可溶性碱 D. 可溶性盐
科目:高中化学 来源: 题型:
【题目】E是一种重要的工业原料,E的合成方法如下:

已知:![]()
回答下列问题
(1)B分子中的官能团名称是_______________。
(2)④过程中的反应类型是_______________。
(3)A的同分异构体有多种,其中有两个侧链,既具有酚的性质又具有醇的性质的物质有_____种;其中有两个甲基的结构简式是______(写一种即可)。
(4)已知:  。设计一条由苯和乙烯为起始原料制备
。设计一条由苯和乙烯为起始原料制备![]() 的合成路线:_______________。
的合成路线:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁的铂丝蘸取无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则下列有关叙述正确的是( )
A.只含有Na+
B.一定含Na+也可含K+
C.既含Na+又含有K+
D.可能含Na+或K+中一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
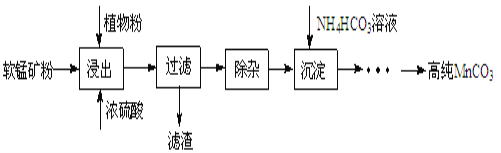
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时,植物粉的作用是_____。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是_____;
操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_____。
(3)制备:在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____;该反应的化学方程式为_____;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是_____。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 为原子序数 1~20 号内的元素,将 4.7g X 的最高价氧化物X2O溶于 95.3g 水中,所 得溶液浓度为 5.6% 。Y 元素原子与 X 元素原子的最外电子层电子数相同,12g Y 的氢氧化物恰好被0.75 mol/L 的盐酸 400mL 所中和。Z、Y 的原子核外电子层数相同,16g ZO2气体在标准状况下的体积 为 5.6L。试求 X、Y、Z 元素名称。X______________,Y_______________,Z____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. NH3 + HCl =NH4Cl
B. 2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
C. H2SO4+2NaOH = Na2SO4+2H2O
D. Cl2 + H2O = HCl + HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com