
【题目】已知某可逆反应mA(g)+nB(g)pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( ) 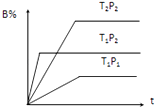
A.T1<T2、P1>P2、m+n>p,△H<0
B.T1>T2、P1<P2、m+n>p,△H>0
C.T1>T2、P1<P2、m+n<p,△H>0
D.T1<T2、P1>P2、m+n<p,△H<0
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
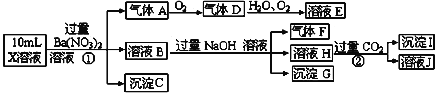
根据以上信息,回答下列问题:
(1)配平①中反应的离子方程式: Fe2+ +H+ +NO3- ===Fe3+ +NO↑+H2O ____
(2)上述离子中,溶液X中除H+外还肯定含有的离子是____,不能确定是否含有的离子是__,若要确定其中阳离子的存在,最可靠的化学方法是____。
(3)沉淀G的化学式为____,写出生成沉淀I的离子方程式____。
(4)假设测定A、F、I均为0.01mol,10ml X溶液中n(H+)=0.04mol,当沉淀C物质的量为0.07mol,能说明(2)中不能确定的阴离子存在的理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A.氧化物中的氧元素一定呈 - 2价B.酸性氧化物可能是金属氧化物
C.化学键只存在于晶体中D.正四面体分子中键角不可能是600
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2 , 在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40 mol
B.0.20 mol
C.小于0.20 mol
D.大于0.20 mol,小于0.40 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石(Cu2(OH)2CO3),主要燃料是木炭,冶炼温度估计在1000℃左右.
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”.“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜.
(1)关于“曾青”和孔雀石的水溶性分析中,判断正确的是__________
A.前者可溶,后者难溶 B.前者难溶,后者可溶
C.两者均可溶 D.两者均难溶
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有__________
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
②2CuO+C ![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO ![]() Cu+CO2
Cu+CO2
④CO2+C ![]() 2CO
2CO
A.①② B.①③ C.①②③ D.①②③
(3)在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)__________,不属于氧化还原反应的有__________.
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式 ______________________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向各盛有1L水的甲、乙、丙、丁四个烧杯内分别加入等物质的量的Na、Na2O、Na2O2和NaOH,固体完全溶解后,各烧杯中溶质的质量分数大小顺序是( )
A. 甲<乙<丙<丁 B. 丁<甲<乙=丙
C. 甲=丁<乙=丙 D. 丁<甲<丙<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 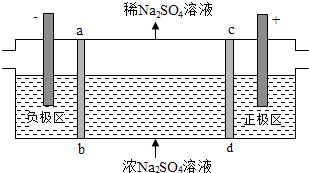
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是( ) 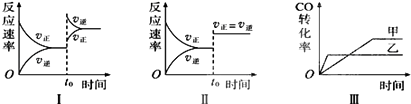
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com