
(1)铝可将水中的NO3-转化为N2,从而消除污染。该反应中涉及的粒子有:H2O、Al、AlO2-、Al(OH)3、NO3-、N2,请将这些粒子中除NO3-以外的粒子填入以下空格内(要配平)
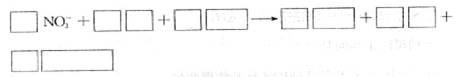
该反应过程中,氧化剂和还原剂的物质的量之比为 。
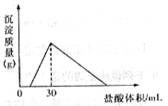
(2)常温下,将一定质量的钠铝合金置于水中,合金全部溶解,
得到20mL pH=14的溶液,然后用2 mol/L盐酸滴定,沉淀质
量与消耗盐酸的体积关系如右图,则反应过程中产生氢气的总
体积为 L(标准状况下)。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
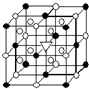 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
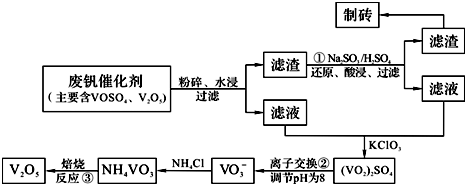
| ||
| ||
| 6 |
| 7 |
| n(SO3) |
| n(SO2) |
查看答案和解析>>
科目:高中化学 来源:2012届江苏省重点中学高三下学期开学质量检测化学试卷 题型:填空题
(12分)当今水体的污染成为人们关注的焦点。利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol·L-1时,溶液中c(PO43-)= mol·L-1。
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 ;与方法一相比,方法二的优点为 。
(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体。现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为 。
(3)工业上也会利用铝粉除去含氮废水中的NO3-。现在处理100m3浓度为2.0×10-4 mol·L-1的NaNO3溶液,加入一定量的2 mol·L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4∶1,求此过程中消耗铝的质量。(写出计算过程,无过程以0分计算)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com