
����Ŀ���±���Ԫ�����ڱ���һ���֣������������ֱַ����ijһԪ�ء�

������ݱ�������Ԫ�أ��ش��������⣺
(1)��������d����Ԫ����_________(����)��
(2)�ݢޢ�����Ԫ���е縺��������_____(��дԪ�ط���)���ڵڶ������е�һ�����ܽ��ڢں͢�֮���Ԫ����_______�֣�
(3)Ԫ�آ������ڱ��е�λ��_______________��
(4)Ԫ�آ�͢����γ�һ�ֳ����ĸ���������ĵ���ʽΪ_____________��
(5)д�������йط�Ӧ�����ӷ���ʽ����ĵ�����Ԫ�آ۵�����������Ӧ��ˮ�����ϡ��Һ��Ӧ��___________________________��
(6)�͢���Ƚϣ��ǽ����Խ�������______(��Ԫ�ط���)��������֤��Ľ��۵��������е�_____(����)��
a.��̬�⻯����ȶ��ԣ� b.��Ԫ�صĵ縺�ԣ�c.����������ԣ� d. ����ϼ�
(7)����۵�Ԫ���γɵ�10�������Է���X�Ŀռ乹��Ϊ_____������������ˮ�У����Ҫ˵��������������ˮ��ԭ��_______________
���𰸡� �� Cl 3 ��4����VII�� ![]() Cu��4H����2NO3����Cu2����2NO2����2H2O S ab ������ �������Ǽ��Է��ӣ���������ˮ����֮���γ����
Cu��4H����2NO3����Cu2����2NO2����2H2O S ab ������ �������Ǽ��Է��ӣ���������ˮ����֮���γ����
������������Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���H��B��N��O��Al��S��Cl��Ca��Fe��Cu����
(1)���칤��ԭ�����ͨ����ӵĹ���������������������d����Ԫ��������(2)ͬ�����������ҵ縺�������ߣ���ݢޢ�����Ԫ���е縺��������Cl���ڵڶ������е�һ�����ܽ��ڢں͢�֮���Ԫ����Be��C��O������Ԫ����(3)��Ԫ�������ڱ��е�λ���ǵ�4�������塣(4)Ԫ�آ�͢����γ�һ�ֳ����ĸ�����Ȼ������������Ӽ������ӻ�������ĵ���ʽΪ![]() ��(5)��ĵ�����Ԫ�آ۵�����������Ӧ��ˮ�����ϡ��Һϡ���ᷴӦ�����ӷ���ʽΪCu��4H����2NO3����Cu2����2NO2����2H2O��(6)ͬ�����������ҷǽ���������ǿ���͢���Ƚϣ��ǽ����Խ�������S��a.�ǽ�����Խǿ���⻯��Խ�ȶ�������̬�⻯����ȶ��Կ���˵����a��ȷ��b.�ǽ�����Խǿ���縺��Խ������Ԫ�صĵ縺�Դ�С����˵����b��ȷ��c.�����������ǿ����һ����˵����Ӧ������ۺ������������c������d. �ǽ�����ǿ���뻯�ϼ�û�й�ϵ��d����ѡab��(7)����۵�Ԫ���γɵ�10�������Է���X�ǰ�������ռ乹��Ϊ�����Σ����ڰ������Ǽ��Է��ӣ���������ˮ����֮���γ��������˰�����������ˮ����
��(5)��ĵ�����Ԫ�آ۵�����������Ӧ��ˮ�����ϡ��Һϡ���ᷴӦ�����ӷ���ʽΪCu��4H����2NO3����Cu2����2NO2����2H2O��(6)ͬ�����������ҷǽ���������ǿ���͢���Ƚϣ��ǽ����Խ�������S��a.�ǽ�����Խǿ���⻯��Խ�ȶ�������̬�⻯����ȶ��Կ���˵����a��ȷ��b.�ǽ�����Խǿ���縺��Խ������Ԫ�صĵ縺�Դ�С����˵����b��ȷ��c.�����������ǿ����һ����˵����Ӧ������ۺ������������c������d. �ǽ�����ǿ���뻯�ϼ�û�й�ϵ��d����ѡab��(7)����۵�Ԫ���γɵ�10�������Է���X�ǰ�������ռ乹��Ϊ�����Σ����ڰ������Ǽ��Է��ӣ���������ˮ����֮���γ��������˰�����������ˮ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȷ�Ӧ����������ұ�����۽�������Fe��V��Mn�ȣ�����Ӧ���������������У� ��
A. ����B. ���õĵ�����
C. �۵��D. ��ԭ�ԣ��ڷ�Ӧ�зų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��BΪ������ͬ���������Ԫ�أ���A��ԭ������Ϊn����B��ԭ������������Ϊ
A.n+16B.n+2C.n+8D.n+10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dz��л�ѧ�еļ���ʵ�飬��ش���ص����⣺
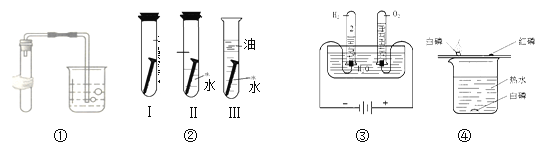
(1)��ͼ��ʾʵ�������ԭ����ͬ����__________��
(2)ʵ�����֤��װ�����ܵ��۽�����______________________________��
(3)Ϊ�ų������ж�����̼�ȶԽ����Ӱ�죬Ӧ��ʵ������ĸĽ���______________��
(4)ͨ��ʵ��ۻ��ˮ�����⡢��Ԫ����ɽ��۵�������___________��_________��
(5)ʵ�����ˮ��������___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ũ��Ϊ0.100 mol��L��1��NaOH��Һ�ֱ���μ��뵽20.00 mL 0.100 0 mol��L��1��HX��HY��Һ����pH��NaOH��Һ����ı仯��ͼ������˵����ȷ����(����)

A. V(NaOH)��10.00 mLʱ��������Һ��c(X��)��c(Y��)
B. V(NaOH)��10.00 mLʱ��c(X��)��c(Na��)��c(HX)��c(H��)��c(OH��)
C. V(NaOH)��20.00 mLʱ��c(OH��)��c(H��)��c(Na��)��c(X��)
D. pH��7ʱ��������Һ��c(X��)��c(Na��)��c(Y��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. 1mol�Ҵ����������������Ʒ�Ӧ������0.5molH2����֤���Ҵ�������һ��Hԭ���������Hԭ�Ӳ�ͬ
B. ���з�Ӧ��֤�������ܼ���Ӱ�죬�ױ��ױ����Ը����������![]()
C. ���з�Ӧ��֤�������ǻ��Ա�����Ӱ�죬���±��ӵ�ȡ���ȱ�����
D. ������ʹ������Ȼ�̼��Һ��ɫ����˵����������û������ϩ���������Ƶ�̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������x�Ǣ�B����Ԫ�ص�ԭ����������ôԭ������Ϊx+1��Ԫ����
A. ��B�� B. ��B�� C. ��A�� D. ��A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����������һ����Ҫ�����Ӽ�����ṹ��ͼ��![]() ����̼�����������ɻ��������������̼��Ӧ���ã��������̼�����Ҷ�����Ӧ��á�����˵����ȷ����
����̼�����������ɻ��������������̼��Ӧ���ã��������̼�����Ҷ�����Ӧ��á�����˵����ȷ����
A. ���������Ʊ���Ӧ������ͬ
B. ̼���������ķ���ʽΪC3H5O3
C. ̼������������ʱӦ�������Ӵ�
D. ̼��������������ԭ�ӿ��ܹ�ƽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com