
| A. | NF3是还原剂,H2O是氧化剂 | |
| B. | N O是还原产物,HNO3是氧化产物 | |
| C. | 在潮湿天气中NF3泄漏常常容易被发现 | |
| D. | 一旦NF3泄漏,可以用石灰水喷淋的方法减少污染 |
分析 NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3该反应中N元素的化合价由+3价降低为+2价,由+3价升高为+5价,所以NF3是氧化剂、还原剂,根据元素化合价变化及转移电子分析解答.
解答 解:NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3该反应中N元素的化合价由+3价降低为+2价,由+3价升高为+5价,
A.根据元素化合价变化知,NF3是氧化剂、还原剂,故A错误;
B.3NF3+5H2O(g)=9HF+2NO+HNO3该反应中N元素的化合价由+3价降低为+2价生成NO,则NO是还原产物,N元素的化合价由+3价升高为+5价生成HNO3,则HNO3是氧化产物,故B正确;
C.NF3和水反应生成NO,NO极易被氧化生成红棕色二氧化氮,所以有颜色变化,则NF3在空气中泄漏时易被察觉,故C正确;
D.一旦NF3泄漏,NF3和水反应生成酸,同时最终生成酸性氧化物,所以可以用石灰水喷淋的方法减少污染,故D正确;
故选A.
点评 本题考查氧化还原反应,正确书写化学反应方程式是解本题关键,明确物质的性质及物质之间的关系即可解答,注意NO在空气中能被氧化,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ | |
| D. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1醋酸 | B. | 1L0.1mol•L-1H2SO4溶液 | ||
| C. | 0.5L0.1mol•L-1盐酸 | D. | 2L0.1mol•L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | Y的最高价氧化物的水化物具有两性 | |
| B. | Z的最高价氧化物常温常压下为固体 | |
| C. | 气态氢化物的稳定性:X>W>Z | |
| D. | 原子半径:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2016年法国、美国和荷兰的三位化学家因“分子马达”方面的研究,获得诺贝尔化学奖.下面是其中一种光驱分子马达的结构,关于其结构的说法正确的是( )
2016年法国、美国和荷兰的三位化学家因“分子马达”方面的研究,获得诺贝尔化学奖.下面是其中一种光驱分子马达的结构,关于其结构的说法正确的是( )| A. | 该分子的化学式为C32H44O2 | |
| B. | 分子中最多有6个原子在一条直线上 | |
| C. | 1 mol该分子最多可与8 molH2发生反应 | |
| D. | 该分子可以发生氧化、加成、酯化和水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
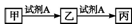
| A. | 若A为氯水,X为金属元素,则甲与丙反应可生成乙 | |
| B. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 | |
| C. | 若A为氧气,丙在通常状况下为红棕色气体,则甲一定为非金属单质 | |
| D. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 带相反电荷的离子之间的相互吸引称为离子键 | |
| B. | 两种非金属原子间不可能形成离子键 | |
| C. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| D. | 某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com