
分析 (1)根据n=$\frac{m}{M}$计算过氧化钠的物质的量,根据反应2Na2O2+2H2O═4NaOH+O2↑计算氧气物质的量,再根据V=nVm计算氧气体积;
(2)根据钠离子守恒计算n(NaOH),再根据c=$\frac{n}{V}$计算NaOH溶液物质的量浓度.
解答 解:(1)过氧化钠的摩尔质量为78g/mol,则n(Na2O2)=$\frac{7.8g}{78g/mol}$0.1mol,
由2Na2O2+2H2O═4NaOH+O2↑可知生成氧气的物质的量为:n(O2)=$\frac{1}{2}$n(Na2O2)=0.05mol,
标况下生成氧气的体积为:V(O2)=0.05 mol×22.4L/mol=1.12L,
答:标况下生成气体的体积为1.12L;
(2)根据钠离子守恒n(NaOH)=2n(Na2O2)=0.2mol,
所得溶液中氢氧化钠溶液物质的量浓度为:$\frac{0.2mol}{1L}$=0.2mol/L,
答:所得溶液的物质的量浓度为0.2mol/L.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
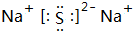 ,D原子的质子数和中子数相等,D的原子组成符号为1632 S.
,D原子的质子数和中子数相等,D的原子组成符号为1632 S.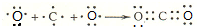 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
 (4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4根据化合价规律可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3 | |
| B. | CaC2能水解:CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O=4A1(OH)3↓+3CH4↑ | |
| C. | Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3 | |
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com