
《梦溪笔谈》中记载有:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜。水能为铜,物之变化,固不可测。该记载中没有涉及的化学反应类型有
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年辽宁东北育才学校高一下第二段考化学试卷(解析版) 题型:选择题
A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知:A、B同周期相邻,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的5倍.下列说法中正确的是( )
A.A、C两元素可能处于第ⅢA族或第ⅥA族
B.D、B两元素组成的两种离子化合物中阴、阳离子数之比为2:1或1:1
C.三种元素的简单离子的半径大小顺序为:C>D>B
D.D、C、B三种元素组成的化合物的化学式为D3CB4
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江哈尔滨六中高三下三模理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]A、B、C、D为原子序数依次增大的四种元素,A2-和B2+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的次外层电子排布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;B的氢化物所属的晶体类型是 ,B单质所形成的晶体,一个晶胞平均含有 个原子。
(3)C和D反应可生成组成比为1:5的化合物E,E的分子式为 ,已知该分子的空间构型为三角双锥,则其中两个Cl原子被F原子所替代得到的产物结构有 种。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与Na2SO3溶液反应,其离子方程式为 。
(5)A和B能够形成化合物F,F晶体中的B2+离子的排列方式如图所示,
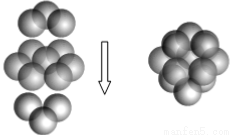
①每个B2+周围最近的等距离的B2+离子有 个。
②已知F的晶胞参数是a0=0.54nm,它的密度为 (只列式不作计算,阿伏加德罗常数为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三考前高考模拟十化学试卷(解析版) 题型:填空题
焦炭与CO、CO2、H2均是重要的化工原料,由CO2制备甲醇过程可能涉及的反应如下:
反应Ⅰ:CO2 (g)+3H2 (g)  CH3OH(g)+H2O(g) △H1 =-49.58kJ·mol -1
CH3OH(g)+H2O(g) △H1 =-49.58kJ·mol -1
反应Ⅱ:CO2 (g)+H2 (g)  CO(g)+H2O(g) △H2 =+41.19kJ·mol -1
CO(g)+H2O(g) △H2 =+41.19kJ·mol -1
反应Ⅲ:CO(g)+2H2(g)  CH3OH(g) △H3
CH3OH(g) △H3
回答下列问题:
(1)反应Ⅲ的△H3 = ,反应Ⅲ自发进行的条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s) +H2O(g)  CO(g)+H2(g),其中H2O、
CO(g)+H2(g),其中H2O、
CO的物质的量随时间的变化曲线如图所示。

①0~1min 内用H2表示该反应的速率为 ,第一个平衡时段的平衡常数是 。
②若反应进行到2min时,改变了温度,使曲线发生如图所示的变化,则温度变化为 (填“升温”或“降温”)。
③反应至5min时,若也只改变了某—个条件,使曲线发生如图所示的变化,该条件可能是下述中的 。
a.加入了C(s) b.加入了水蒸气
c.降低了温度 d.增大了压强
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应Ⅰ、Ⅱ、Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(曲线a)及CH3OH 的产率(曲线b),如图所示,请回答问题:
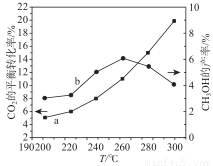
据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”),其原因是 。
(4)若以CO、O2、K2CO3等构成的熔融盐电池为电源,用惰性电极电解200mL 饱和食盐水,则负极上的电极反应式为 ,当有2.8g燃料被消耗时,电解池中溶液的pH= (常温下,忽略溶液的体积变化,不考虑能量的其他损耗)。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三考前高考模拟十化学试卷(解析版) 题型:选择题
取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化,则转化过程中所加稀HNO3的物质的量浓度为
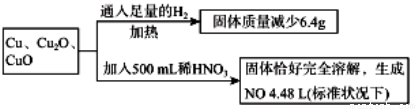
A.4.4mol·L -1 B.3.6mol·L -1 C.4.0mol·L -1 D.3.2mol·L -1
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:实验题
现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,进行如下实验:
①称取混合物样品的质量7.06g,将样品溶解
②向溶解后的溶液中,加入足量的双氧水
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g
根据实验回答下列问题:
(1)样品溶解过程中需加入___________,以防止__________________;
(2)写出溶解后的溶液与双氧水反应的离子方程式____________;
(3)过滤操作中除用漏斗外,还需要的玻璃仪器有____________;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法____________;
(5)通过实验所得数据,计算固体样品中FeCl2的质量分数:____________;
(6)实验室采用下列装置制取少量无水FeCl3固体。(已知FeCl3固体易潮解,部分夹持仪器已略去。)
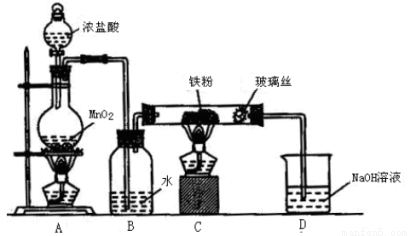
该装置存在明显缺陷,得不到无水FeCl3固体,请你对该装置进行合理的改进:____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:选择题
往碘化亚铁溶液中缓慢通入1.5mol氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量为
A.1.1mol B.1.5mol C.1.2mol D.1.0mol
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:填空题
BPA的结构简式如右下图所示,常用来生产防碎塑料聚碳酸酯。
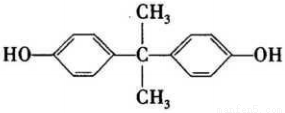
(1)该物质的分子式为___________,含氧官能团的名称是_________,属于____类。
(2)该物质最多_____个碳原子共面。
(3)充分燃烧0.1mol该有机物,消耗的O2在标准状况下的体积为_________。
(4)下列关于BPA的叙述中,不正确的是_______。
A.可以发生还原反应
B.遇FeCl3溶液紫色
C.1mol该有机物最多可与2molH2反应
D.可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
B.一定温度下,1L0.50mol/LNH4NO3溶液中含氮原子个数为NA
C.过氧化氢分解制得标准状况下1.12LO2,转移电子数目为0.2NA
D.28g分子式为CnH2n的链烃中含有的C-H键的数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com