
【题目】X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
X | Y | Z | |
原子半径/nm | 0.154 | 0.130 | 0.071 |
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是
A. 原子最外层电子数:Z>X>Y
B. 三种元素可能为同周期元素
C. 原子序数:Y>X>Z
D. 离子半径:X>Y>Z
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是 ( )
A. 铜铸塑像上出现铜绿[Cu2(OH)2CO3] B. 充有氢气的气球遇明火爆炸
C. 大理石雕像被酸雨腐蚀毁坏 D. 铁质菜刀生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列 6 种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为了确认溶液的组成,进行了如下实验:
①取 200mL 上述溶液,加入足量 BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀 4.30g。向沉淀中加入过量的盐酸,有2.33g沉淀不溶解。
②向①的滤液中加入足量NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体1.12L (已换算成标准状况,假定产生的气体全部逸出)。
③原溶液焰色反应呈黄色。
关于原溶液组成的结论,不正确的是
A.一定存在Cl-、SO42-、CO32-、NH4+,可能存在Na+、K+
B.至少存在五种离子,且c(Cl-)≥0.05mol/L
C.c(CO32-)=0.05mol/L
D.c(NH4+)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在2L密闭容器中,起始投入4 molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
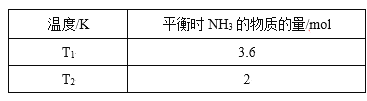
①则K1______K2,(填“>”、“<”或“=”)原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1 mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A.3v(H2)正=2v(NH3)逆 B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.△H保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:__________。
(3)下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
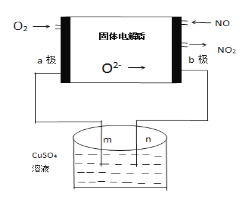
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的PH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 mol·L-1的氨水中有0.1NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1 H2X溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是

A.水电离出来的c(OH-):D点>B点
B.C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+)
C.B点:c(HX-)>c(H+)>c(X2-)>c(H2X)
D.A点溶液中加入少量水:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 常温常压下,8gO2和O3的混合气体含有4NA个电子
B. 1L0.1mol/L的FeCl3完全水解,形成0.1NA个Fe(OH)3胶体粒子
C. 标准状况下,22.4LCl2通入水中发生反应,转移的电子数为NA
D. 1molNa被完全氧化生成Na2O2,失去个2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含有NaCl、Na2CO3.10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应前后CO2和H2O的质量,来确定该混合物中各组分的质量分数.
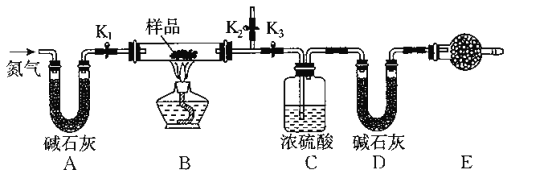
(1)实验步骤
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_______________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1 K2,关闭K3,缓慢鼓入氮气数分钟,其目的是_____________________。
④关闭活塞K1 K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓慢鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是__________________________。
②E处干燥管中盛放的药品是_________,其作用是_________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为wg,反应后C、D装置增加的质量分别为mg、ng,则混合物中Na2CO3.10H20的质量分数为________(用含w、m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有![]() 个氩原子的氩气在标准状况下的体积约为22.4L
个氩原子的氩气在标准状况下的体积约为22.4L
B.标准状况下,11.2L![]() 含有的分子数为0.5
含有的分子数为0.5![]()
C.在常温常压下,11.2 L ![]() 含有的分子数为0.5
含有的分子数为0.5![]()
D.常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com