
原气体为CO2、H2O的混合气,2CO2+2Na2O2====2Na2CO3+O2,
2H2O+2Na2O2====4NaOH+O2,产生O2 1.6 g。
解析:①在100 ℃条件下,与Na2O2反应放出O2的气体可能是CO2,可能是H2O或是两者的混合物。先假设A气体为CO2,与CO2反应的Na2O2的质量为x,生成Na2CO3的质量为y。
2CO2 + 2Na2O2====2Na2CO3+O2
88 2×78 2×106
3.88 g x y
x=![]() ×2×78=6.878 g
×2×78=6.878 g
y=![]() ×2×106=9.347 g
×2×106=9.347 g
y-x=9.347-6.878=2.46 g>2.28 g,故设A为CO2不成立。再设A气体为H2O(气)。同理,A为H2O(气)也不成立。
故A气体为CO2与H2O(气)组成的混合气体,反应方程式为
2CO2+2Na2O2====2Na2CO3+O2,2H2O+2Na2O2====4NaOH+O2
②设产生氧气质量为x,则依质量守恒:气体减轻=固体增重,则
3.88 g-x=2.28 g
x=3.88 g-2.28 g=1.6 g
原气体为CO2、H2O的混合气,产生O2 1.6 g。


科目:高中化学 来源: 题型:阅读理解
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 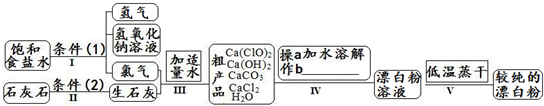 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去.该学生为了了解该过程的原因,进行了下列探究过程: [实验探究] 实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊. 实验4: ①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5. ②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8. ③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1. 请根据上述实验回答下列问题: (1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外) HCO3-?CO32-+H+ HCO3-?CO32-+H+ 、HCO3-+H2O?H2CO3+OH- HCO3-+H2O?H2CO3+OH- .这两个平衡以水解平衡 水解平衡 为主,理由是溶液显碱性 溶液显碱性 .(2)实验3得到的结论是 加热0.1mol/LNaHCO3溶液,NaHCO3发生分解反应,产生二氧化碳 加热0.1mol/LNaHCO3溶液,NaHCO3发生分解反应,产生二氧化碳 .(3)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是 水分蒸发 水分蒸发 、NaHCO3发生分解反应 NaHCO3发生分解反应 、NaHCO3水解平衡被促进 NaHCO3水解平衡被促进 .(4)实验4①得到的结论是 相同温度下,Na2CO3的水解能力和溶液碱性大于NaHCO3 相同温度下,Na2CO3的水解能力和溶液碱性大于NaHCO3 .(5)实验4②“加水至200mL”的目的是 排除因水分蒸发导致pH增大的因素 排除因水分蒸发导致pH增大的因素 .实验4③可以得到的结论是 NaHCO3常温下即可发生分解反应 NaHCO3常温下即可发生分解反应 .(6)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是 NaHCO3发生分解生成碳酸钠?还是水解平衡向右移动?还是两者皆有 NaHCO3发生分解生成碳酸钠?还是水解平衡向右移动?还是两者皆有 .查看答案和解析>> 科目:高中化学 来源: 题型: 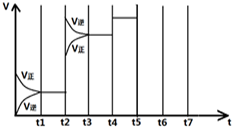 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示: 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
a、Q2<Q1<197kJ b、X2<X1<100% c、Q1=78.8 d、X1=2X2 (2)某时刻甲容器内反应达到平衡,保持恒温恒容; ①假设又向容器内加入一定量的SO2气体,则X(SO2) ②假设又向容器中加入一定量的SO3(g),X(SO2) (3)平衡时,乙容器中SO2的体积分数为 (4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个). ①t2时改变的条件是 ②若t 5时降低压强,试画出v-t图象③若各阶段对应的平衡常数如图所示
查看答案和解析>> 科目:高中化学 来源: 题型: 氢氧燃料电池是一种用氢气作为能源的电池.这种燃料电池的效率要比传统内燃机的效率高很多,所以燃料电池汽车(FCV)会有很高的效率.Schlesinger等人提出可用NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原).该反应的产氢速率受外界条件影响.下表为pH和温度对NaBH4 半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).
(1)已知,NaBH4与水反应后所得溶液显碱性,则溶液中各离子浓度大小关系为 (2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?答: (3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?答: (4)实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应).其可能原因是 查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 请运用化学反应原理的相关知识研究碳及其化合物的性质. (1)请完成该反应的化学方程式:(系数按顺序填在答题卷上) (2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式: (3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F,E和F均为空气的组成成分.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
②根据上述信息判断,温度T1和T2的关系是(填序号) a.T1>T2 b.T1<T2 c.无法比较 (4)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸.回答下列问题: ①所得溶液的溶质是 ②溶液中下列关系正确的是 a.c(Na+)>c(CO
b.c(Na+)>c(HCO
c.c(Na+)=2c(CO
d.c(H+)+c(Na+)=c(OH-)+2c(CO
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的一定浓度的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为1.9×10-4mol/L,则混合后若生成沉淀所需原CaCl2溶液的最小浓度为 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||