
从理论上说氧化还原反应可以设计为原电池.试根据反应:Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池并写出电极反应.
|
【答案】(见图)正极(石墨):2Fe3++2e-=2Fe2+ 负极(Cu):Cu-2e-=Cu2+
【解析】联想铜、锌硫酸原电池的正、负极和电池总反应:Zn+H2SO4=ZnSO4+H2↑,分析氧化还原反应:Cu+2FeCl3=CuCl2+2FeCl2,Cu被氧化,因而作负极;FeCl3被还原,作电解质;再选择一种比铜更不活泼的金属或石墨作正极,即可构成原电池. 【拓展延伸】任何氧化还原反应都可以设计为原电池.设计原电池时,先分析氧化还原反应,理论上被氧化的物质作负极,被还原的物质作正极,一般负极为被氧化的较活泼金属,正极为不参与电极反应的导电物质石墨或另一种较不活泼金属.在燃料电池中,两电极材料为同种不活泼金属或石墨. |


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:058
从理论上说氧化还原反应可以设计为原电池.根据反应:
Cu+2FeCl3![]() CuCl2+2FeCl2
CuCl2+2FeCl2
设计一个原电池并写出电极反应,并画出简易图.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三9月份月考化学试卷 题型:选择题
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
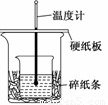
A.如图条件下实验过程中没有热量损失
B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等
C.图中实验装置缺少环形玻璃搅拌棒
D.烧杯间填满碎纸条的作用是固定小烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com