
【题目】处理工业酸性废水中NO3-的电解池工作原理如图所示,电解总反应为4NO3-+4H+![]() 2N2↑+5O2↑+2H2O。下列说法正确的是
2N2↑+5O2↑+2H2O。下列说法正确的是
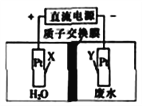
A. X电极上发生还原反应
B. Y电极上发生的电极反应为2NO3-+10e-+12H+==N2↑+6H2O
C. 电解池工作时,H+从质子交换膜右侧向左侧移动
D. 电解池工作时,电路中每通过2mol电子,生成15.68L气体
 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大.已知在周期表中A是原子半径最小的元素,B的气态氢化物能与其最高价氧化物的水化物反应,C原子最外层电子数是电子层数的3倍,D+和E3+离子的电子层结构相同,C与F属于同一主族.请回答下列问题:
(1)F在元素周期表中的位置是________________。
(2)上述B、C、D、E、F、G元素形成的简单离子中,半径最小的是_______(填离子符号)。
(3)由上述元素中的一种或几种组成的物质甲可以发生如图反应:
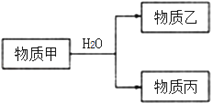
①若乙具有漂白性,则乙的电子式为________。
②若丙的水溶液是强碱性溶液,则甲为________________(填化学式)。
(4)G和F两种元素相比较,非金属性较强的是(填元素名称)________,可以验证该结论的是________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的含氧酸的酸性
(5)A、B两种元素形成一种离子化和物,该化合物所有原子最外层都符合相应稀有气体原子最外层电子结构则该化合物电子式为________________。
(6)由A、B、C、F、四种元素组成的一种离子化合物X,已知:① 1 mol X能与足量NaOH浓溶液反应生成标准状况下22.4 L气体;② X能与盐酸反应产生气体Y,该气体能与氯水反应,则X是________________(填化学式),写出该气体Y与氯水反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下(T2>T1),在3个体积均为2.0L的恒容密闭容器中反应2NO(g)+Cl2(g)=2ClNO(g) (正反应放热)达到平衡,下列说法正确的是
容器 | 温度/ (℃) | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(NO) | c(Cl2) | C(ClNO).v | C(ClNO) | ||
Ⅰ | T1 | 0.20 | 0.10 | 0 | 0.04 |
Ⅱ | T2 | .020 | 0.10 | 0.20 | cl |
Ⅲ | T3 | 0 | 0 | 0.20 | C2 |
A. 达到平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1:2
B. 达到平衡时,容器Ⅲ中ClNO的转化率小于80%
C. 达到平衡时,容器Ⅱ中c(ClNO)/C(NO)比容器Ⅰ中的大
D. 若温度为T1,起始时向同体积恒容密闭容器中充入0.20molNO(g).、0.2mo1Cl2(g)和0.20molClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 = Cu + FeSO4。下列有关该反应的说法正确的是
A.Fe是氧化剂B.CuSO4 为还原剂
C.Fe被还原D.CuSO4 发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
A. X:3s23p2 Y:3s23p5 B. X:2s22p3 Y:2s22p4
C. X:3s23p1 Y:2s22p5 D. X:2s22p3 Y:1s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Na2SO4、NaCl、MgCl2的1L混合溶液c (Na+) = 0.5 mol/L,c(Cl-)=0.4 mol/L,c(Mg2+)= 0.15 mol/L则此溶液中c (SO42-)为
A.0.15 mol/LB.0.2 mol/L
C.0.3 mol/LD.0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如图: 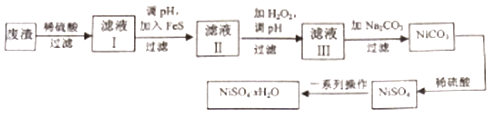
(1)在待镀件上镀镍时,待镀件应作极,电镀过程中电解质溶液浓度 (填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为 . 当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10﹣5mol/L,则c(Cu2+)=mol/L (已知Ksp(CuS)=1.3×10﹣36 , Ksp(ZnS)=1.6×10﹣24).
(3)对滤液Ⅱ中先加H2O2再调pH,调pH的目的是 .
(4)滤液Ⅲ溶质的主要成分是NiSO4 , 加入Na2CO3过滤后再加适量稀硫酸溶解又生成NiSO4 , 这两步操作的目的是 .
(5)为测定NiSO4xH2O晶体x的值,称取26.3g晶体加热至充全失去结晶水,剩余固体15.5g,则x的值等于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是 ( )
A.Mg变为MgO时化合价升高,因此,Mg在该反应中被氧化
B.非金属单质在反应中只作氧化剂
C.肯定有一种元素被氧化,另一种元素被还原
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 
A.图中a点对应的是AgBr的不饱和溶液
B.在t°C时,AgBr的Ksp为 4.9×10﹣13
C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D.在t°C时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)的平衡常数K≈816
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com