
科目:高中化学 来源: 题型:阅读理解

| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间 \CO转化率 \温度 |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 序号 | 甲 | 乙 | 丙 |
| 方案 | 用广泛pH试纸 检测溶液pH |
滴加等体积0.1mol?L-1 Ba(OH)2溶液 |
滴加等体积0.1mol?L-1 CaCl2溶液 |
| 0.01mol?L-1溶液 | NaHCO3 | Na2CO3 |
| c(CO32-)/mol?L-1 | 0.00011 | 0.0087 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
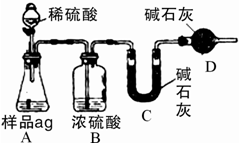
(一)甲组:
实验方案:镁铝合金![]() 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量用托盘天平称量
②溶解把①中药品加入烧杯中,用规格为___________mL的量筒量取一定体积1 mol·L-1 NaOH 溶液加入烧杯中,不断搅拌,充分反应
③过滤
④洗涤若未对过滤所得固体进行洗涤,测得铝的质量分数将__________(填“偏高”“偏低”或“不变”),证明固体已洗涤干净的方法为________________________________________。
⑤干燥、称量剩余固体
(二)乙组:
实验方案:
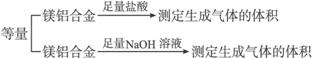
实验装置:
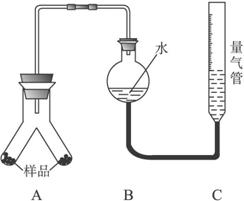
实验步骤:
①按上图连接好装置。
②称取两份质量均为
③通过注射器的针头向装置A左侧管中注入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为448 mL。
④通过另一针头向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为672 mL。
问题和讨论:
(1)上述实验步骤①和②之间必须加一步________的操作,具体方法为__________________。
(2)为使气体体积测定结果不至于引起很大偏差,除了应注意使B和C中的液面相平外,在反应完全后至读数之前,还需要注意的关键问题是(只需写出一点)_________________。
(3)计算合金中铝的质量分数时,是否需要将气体体积折算为标准状况的体积。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 CaCO3
CaCO3  2MgO+C
2MgO+C 
 CH3OH(g)。某研究小组将2 mol
CH3OH(g)。某研究小组将2 mol 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com