
| A、在任何情况下都存在c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | B、当溶液中c(CH3COO-)>c(Na+)时.溶液可能显中性 | C、当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量 | D、当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,可能是醋酸过量 |


科目:高中化学 来源:2010-2011学年湖南省高三第六次月考理综化学部分 题型:选择题
常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应。下列说法不正确的是 ( )
A 在任何情况下都存在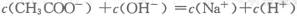
B 当溶液中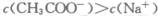 时,溶液可能显中性
时,溶液可能显中性
C 当溶液中pH<7时,一定是醋酸过量
D 当溶液中pH〉7时,醋酸可能过量
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高二第二学期期末考试化学试卷 题型:选择题
下列溶液中有关微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应
当溶液中c(Na+)>c(CH3COO-) >c(OH-)>c(H+)时,醋酸一定过量
C. 在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D. 在0.1mol·L—1NH4HSO4溶液中:c(H+)>c( SO42-)>c(NH4+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com